Ферментативные реакции.
Уравнение Михаэлиса

На рис. 16.2 приведено сравнение энергетических профилей некаталитического и каталитического (ферментативного) процессов. Энергия фермент-субстратного комплекса меньше энергии свободных субстратов (реагентов) на величину энергии адсорбции субстратов на ферменте (Еадс). При этом энергия активации ферментативного процесса (Ед ф) меньше энергии активации неферментативного процесса (ЕА). Характерной… Читать ещё >
Ферментативные реакции. Уравнение Михаэлиса (реферат, курсовая, диплом, контрольная)
Ферментативный катализ — каталитические реакции, протекающие с участием ферментов — биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности.
- 1. Высокая активность, на несколько порядков превышающая активность неорганических катализаторов, что объясняется очень значительным снижением энергии активации процесса ферментами. Так, константа скорости реакции разложения перекиси водорода, катализируемой ионами Fc2+, составляет 56 с-1; константа скорости этой же реакции, катализируемой ферментом каталазой, равна 3,5 ¦ 107, т. е. реакция в присутствии фермента протекает в миллион раз быстрее (энергии активации процессов составляют соответственно 42 и 7,1 кДж/моль). Константы скорости гидролиза мочевины в присутствии кислоты и уреазы различаются на 13 порядков, составляя 7,4 • 10 7 и 5 • 106 с 1 (величина энергии активации составляет соответственно 103 и 28 кДж/моль).
- 2. Высокая специфичность. Например, амилаза катализирует процесс расщепления крахмала, представляющего собой цепь одинаковых глюкозных звеньев, но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов.
На рис. 16.2 приведено сравнение энергетических профилей некаталитического и каталитического (ферментативного) процессов. Энергия фермент-субстратного комплекса меньше энергии свободных субстратов (реагентов) на величину энергии адсорбции субстратов на ферменте (Еадс). При этом энергия активации ферментативного процесса (Ед ф) меньше энергии активации неферментативного процесса (ЕА).
Согласно общепринятым представлениям о механизме простейших ферментативных реакций, которые были предложены Михаэлисом и Меитеи, субстрат S и фермент Е находятся в равновесии с очень быстро образующимся фермент-субстратным комплексом ES. Этот комплекс сравнительно медленно распадается на продукт реакции Р и свободный фермент Е. Таким образом, стадия распада фермент-субстратного комплекса на продукты реакции является лимитирующей.
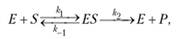
где кj константа скорости образования фермент-субстратного комплекса; к— константа скорости обратной реакции, распада фермент-субстратного комплекса; к2 — константа скорости образования продукта реакции.
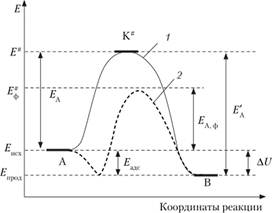
Рис. 16.2. Сравнение энергетических профилей нскаталитичсского (1) и каталитического процессов (2)
Следующее соотношение констант скоростей 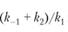 называют константой Михаэлиса и обозначают Кт.
называют константой Михаэлиса и обозначают Кт.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, а скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES. Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т. е. в фермеит-субстратном комплексе ES, т. е. [Е] = [ES).
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением:
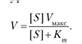
Это уравнение получило название уравнения Михаэлиса — Ментен.
В случае когда скорость реакции равна половине максимальной, Кт = [S] (рис. 16.3). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.
Уравнение Михаэлиса — Ментен — основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
Если концентрация субстрата значительно больше Кт (S «Кт), то увеличение концентрации субстрата на величину Кт практически не влияет на сумму (Кт + S) и ее можно считать равной концентрации субстрата.
Следовательно, скорость реакции становится равной максимальной скорости: v = vмакс. В этих условиях реакция имеет нулевой порядок, т. е. не зависит от концентрации субстрата. Можно сделать вывод, что vмакс — величина постоянная для данной концентрации фермента, нe зависящая от концентрации субстрата. Если концентрация субстрата значительно меньше Кш (S «Кт), то сумма (Кm + S) примерно равна Кт, следовательно, v = vMaKC[S]/Km, т. е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок).
vмакс и Кгп — кинетические характеристики эффективности фермента.
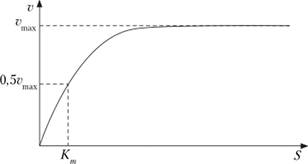
Рис. 16.3. Зависимость скорости реакции (а) от концентрации субстрата (S):
vmax — максимальная скорость реакции при данной концентрации фермента в оптимальных условиях проведения реакции; Кт — константа Михаэлиса.
vмакс дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т. е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кт характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше Кт, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции, и наоборот, чем больше Кт, тем ниже начальная скорость реакции, тем меньше сродство фермента к субстрату.
Характерной особенностью действия ферментов является также высокая чувствительность ферментов к внешним условиям — pH среды и температуре. Ферменты активны лишь в достаточно узком интервале pH и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении pH или температуры.