Газовый режим водоемов

Метан (СН4). Образуется за счет бактериального разложения клетчатки и других органических веществ в толще воды и грунтах пресных водоемов, реже в морях (в основном в анаэробных условиях). Метан — важное звено в круговороте углерода в водных экосистемах. Так, около половины органического углерода, поступающего в донные отложения, выделяется затем в форме метана. Обычно его объем составляет около… Читать ещё >
Газовый режим водоемов (реферат, курсовая, диплом, контрольная)
Наибольший интерес в газовом режиме водоемов представляет концентрация кислорода (02), свободной углекислоты (С02), сероводорода (H2S) и метана (СН4).
Газовый режим морей и пресных водоемов тесно связан с термическими и биологическими процессами, активной реакцией среды (pH) и др. Распределение газов по глубине иногда приобретает довольно сложный характер, объясняемый индивидуальными особенностями водоема и интенсивностью биологических процессов (Л. К. Давыдов, А. А. Дмитриева, Н. Г. Конкина, 1973).
Кислород. Это один из основных факторов, обеспечивающих наличие жизни в водоемах. Обогащение воды кислородом в основном происходит за счет его инвазии (вторжения) из атмосферы и выделения фотосинтезирующими организмами. Убыль 02 связана с его эвазией (выходом) из воды в атмосферу и потреблением при дыхании животными и растениями (А. С. Константинов, 1979).
Коэффициент адсорбции 02 водой при 0 °C равен 0,4 898. Следовательно, при нормальном содержании этого газа в атмосфере (210 мл/л) в 1 л воды окажется растворенным 210 мл 0,4 898 =.
Таблица 4.
Растворимость атмосферного кислорода (мл/л) в воде в зависимости от температуры и солености.
Температура, °С. | Растворимостысислорода при солености воды, % | ||||
10,29. | 9,65. | 9,01. | 8,36. | 7,71. | |
8,02. | 7,56. | 7,10. | 6,63. | 6,17. | |
6,57. | 6,22. | 5,88. | 5,53. | 5,18. | |
5,57. | 5,27. | 4,96. | 4,65. | 4,35. | |
= 10,29 мл кислорода. На содержание кислорода в воде большое влияние оказывают ветровое волнение и течения. Роль диффузии атмосферного 02 в спокойной воде имеет весьма малое значение.
Кислород отличается умеренной растворимостью в воде, которая зависит от ряда факторов, прежде всего от температуры и солености. С их повышением коэффициент адсорбции уменьшается и содержание 02 в воде снижается (табл. 4).
Кислородный режим водоемов зависит от многих факторов. Учитывая, что инвазия 02 из атмосферы происходит только через поверхность воды, а зона фотосинтеза располагается в верхнем слое, последний, как правило, более насыщен кислородом, чем нижележащая толща. В процессе фотосинтеза растения выделяют огромное количество кислорода. В отдельные периоды сезона его содержание в воде в 3 — 4 раза превышает то количество, которое могло бы поступить из атмосферы.
Абсолютный показатель содержания кислорода в водоеме не показывает полностью, много или мало его в воде при данных условиях, поэтому очень часто используют иной показатель — относительное содержание 02 в воде (в процентах насыщения воды кислородом по отношению к нормальной величине его растворимости при данных температуре и давлении):

где а — количество кислорода в воде; N — нормальное количество кислорода при данной температуре и давлении 760 мм рт. ст.; Р — атмосферное давление.
Пересыщение воды кислородом бывает особенно значительным при цветении фитопланктона. В морских водоемах максимальное содержание кислорода в поверхностных слоях не превышает 110—120% от полного насыщения. Зона фотосинтеза находится в верхнем слое (до глубины 20 — 50 м), который, как правило, более насыщен кислородом, чем остальная толща воды. В пресных водоемах концентрация водорослей выше, а фотосинтез осуществляется более интенсивно; концентрация 02 нередко достигает 300% и выше от полного насыщения воды кислородом.
Снижение концентрации кислорода в воде осуществляется в результате его выхода из воды в атмосферу из пересыщенной воды кислородом. Особенно интенсивно это осуществляется при повышении температуры. Значительное количество кислорода тратится организмами при дыхании. Особенно велико потребление 02 бактериями — до 90% от всего количества, потребляемого другими организмами. Кроме того, часть кислорода расходуется на окисление минеральных и органических соединений.
Поступление кислорода в водоем (из атмосферы и в результате фотосинтеза растений) ограничивается только верхним слоем воды. Потребление кислорода для дыхания и окислительных процессов происходит во всей толще воды, в том числе и на дне. Поэтому в водоемах с интенсивными деструкционными процессами дефицит кислорода бывает весьма значительным.
В больших и глубоких водоемах (в основном олиготрофного типа) с относительно низкими температурами воды в течение большей части года и малым содержанием биогенных элементов кислородный режим связан с температурой и условиями перемешивания водных масс. Содержание кислорода в этих водоемах повышенное и близкое к полному насыщению.
Максимальная концентрация кислорода (мг/л) в этих водоемах наблюдается в предледоставный период, что соответствует хорошей его растворимости при низкой температуре. В период весенней и осенней гомотермии кислород распределяется равномерно во всей толще. Летом кислородный максимум может несколько смещаться в толщу воды (за счет фотосинтетических процессов микроводорослей).
В мелких, хорошо прогреваемых озерах эвтрофного типа, с обилием водной растительности (прибрежной и фитопланктона), животных и богатых органическим веществом режим газов определяется в основном биологическими процессами, протекающими в толще воды и в иле.
Летом в распределении 02 наблюдается отчетливо выраженная стратификация, аналогичная температурной. Верхние слои водоема сильно насыщены кислородом; с увеличением глубины концентрация его резко падает. В неглубоких водоемах биологические процессы в придонных слоях и в иле бывают настолько интенсивными, что образуют дефицит кислорода.
В металимнионе также возможен дефицит кислорода. Это связано с интенсивными биологическими процессами в этом слое за счет концентрирования здесь легкоокисляемого органического вещества, поступающего из эпилимниона. Перепад температур в слое температурного скачка способствует задерживанию на границе холодного слоя отмерших планктонных организмов.
Зимой при ледоставе приток 02 становится ничтожным. К концу зимы его содержание уменьшается как в эпилимнионе, так и в более глубоких слоях водоема. В гиполимнионе интенсивное потребление кислорода приводит к заморам, в результате чего гибнут многие животные, в том числе и рыба.
В эвтрофных водоемах максимальное количество кислорода наблюдается во время весенней и осенней циркуляций. В теплое время года в течение длительного периода устойчивой стратификации запасы 02 в гиполимнионе могут быть полностью исчерпаны уже к середине лета. Если в это время под влиянием ветра поверхностные и глубинные воды перемешиваются, то в эпилимнионе на какой-то момент концентрация 02 может резко снизиться, что иногда приводит к заморам и в верхнем слое водоема.
Все озера можно разделить на голомиктические, где перемешивание воды в течение всего летнего сезона идет до дна, димиктические и меромиктические, где летом устанавливается температурная стратификация (В. М. Горленко, Г. А. Дубинина, С. И. Кузнецов, 1977).
В таких озерах объем аэробной зоны начинает более или менее быстро сокращаться в зависимости от трофности водоема; в придонных слоях, а иногда и во всей зоне гиполимниона создается анаэробная обстановка. Так, в олиготрофных водоемах аэробная зона сохраняется круглый год во всей водной массе; в мезотрофных водоемах в придонных слоях кислород исчезает в конце лета и зимы, а пополняется в периоды весенней циркуляции. В эвтрофных озерах в зависимости от степени трофии кислород может исчезать в течение 2—3 недель после весенней и осенней циркуляций.
В водной среде значительная часть животных и бактерий населяет глубины, где света для существования фотосинтезирующих растений недостаточно и, следовательно, дышать им приходится за счет 02, поступающего извне (из атмосферы и верхних слоев воды, где происходит фотосинтез растений). Из-за этого организмам часто приходится испытывать острый дефицит кислорода. Для водных организмов кислород является важнейшим фактором существования.
По отношению к кислороду водные организмы делятся на эври- и стеноксидные формы (эври-и стеноксибионты), способные жить в пределах широких и узких колебаний концентрации 02 соответственно. К эврибионтам относятся рачки Cyclops strenuus, многие рачки рода Daphnia, черви Tubifex tub if ex, моллюски Viviparus v/v/- parus и ряд других организмов, живущих в условиях почти полного отсутствия или высокого содержания 02. Все они являются обитателями зарослей прибрежно-водной растительности.
Водные растения в меньшей степени зависят от наличия кислорода, чем животные, так как сами являются его продуцентами.
Однако в некоторых водоемах при повышении температуры воды и разложении отмерших организмов наблюдается дефицит кислорода, что сказывается на жизнедеятельности как животных, так и погруженных растений (на последних, в основном опосредованно). Отсутствие кислорода приводит к изменению окислительно-восстановительного потенциала среды, концентрации водородных ионов, появлению сероводорода и метана. Все это неблагоприятно отражается на физиологических процессах водных растений.
Углекислота. Обогащение природных вод углекислым газом происходит за счет его диффузии из атмосферы, в результате дыхания водных организмов, геохимических процессов (разрушения осадочных пород), поступления из различных соединений в первую очередь угольной кислоты. Снижение концентрации углекислого газа в воде происходит в результате его потребления фотосинтезирующими организмами и связывания в соли угольной кислоты.
В водоемах концентрация С02 невелика. Так, при 0 °C в 1л чистой воды может раствориться 0,5 мл С02. С повышением температуры и солености растворимость С02 в воде снижается. В природных условиях вода поглощает гораздо больше углекислоты благодаря связыванию С02 в карбонаты кальция или магния.
С увеличением глубины концентрация С02 повышается, особенно зимой, когда ледяной покров препятствует его выходу в атмосферу. К примеру, в гиполимнионе озер концентрация свободной углекислоты достигает 10—20 мг/л. В эпилимнионе во время цветения водорослей она может почти полностью потребляться. При этом pH смещается в щелочную сторону. Такие резкие изменения концентрации С02 в толще водоемов в основном обусловлены биологическими процессами.
Когда двуокись углерода (С02) растворяется в воде, она частично реагирует с водой, образуя угольную кислоту, причем равновесие сильно сдвинуто влево:

Угольная кислота диссоциирует с образованием ионов Н* и гидрокарбонатного иона (НСО (): 
Гидрокарбонатный ион может потерять ион Н+, тогда он становится карбонатным ионом (С03~):
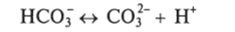
Относительные концентрации Н2С03, HCOJ и С03" зависят от концентрации водородных ионов (Н*) в растворе. При низких значениях pH (4 — 6) наблюдается высокая относительная концентрация Н2С03; при высоких (pH 9—11) значениях преобладает С03~, а при средних (pH 6 —9) — бикарбонаты (HCOj).
Ионы НС03 и С03", реагируя с ионами различных элементов, образуют соли, из которых в природных водах наибольшее значение имеют карбонаты кальция и карбонаты магния. Так как растворимость СаС03 не очень высокая, данные соли уже при небольших концентрациях ионов Са2+ и С03‘ выпадают в осадок. Это наблюдается в щелочной среде, когда количество ионов С032~ становится выше некоторого критического значения.
Когда вода подкисляется и количество ионов СО2", образующихся за счет диссоциации угольной кислоты, понижается, кислота начинает поступать в воду в результате растворения монокарбонатов. Если реакция воды остается кислой, ионы С03" превращаются в ионы НС03 (происходит связывание ионов Н+ и повышение pH), а дефицит первых покрывается образованием дополнительных количеств за счет дальнейшего растворения монокарбонатов. Процесс растворения монокарбонатов будет идти до тех пор, пока не истощится их запас или не повысится pH среды, подщелачивающейся в результате растворения монокарбонатов. Обратная картина будет наблюдаться в щелочной среде: в результате повышения концентрации ионов С03 (соответствующая диссоциация Н2С03) они, соединяясь с ионами Са, образуют осадок СаС03, при этом среда подкисляется (накапливаются ионы Н+).
Таким образом, в природных водах создается буферная система, предупреждающая заметное изменение pH среды, пока в ней содержатся карбонаты и есть контакт с С02 атмосферы (А.С.Константинов, 1979).
Подвижное равновесие отражает схема.

Огромное влияние на содержание свободной углекислоты оказывает фотосинтетическая деятельность водных растений. В летний период при интенсивном фотосинтезе С02 может полностью исчезать из воды. Активная реакция среды при этом смещается в щелочную сторону.
Высшая водная растительность, активно потребляя углекислый газ, способствует осаждению известковых солей на своей поверхности в виде известковых корочек. В процессе фотосинтеза растения могут высоко поднимать активную реакцию среды. Это связано с тем, что снабжение углекислотой растений возможно только посредством утилизации бикарбонатов, поскольку с повышением pH свободная углекислота связывается в углекислые соли. Водные растения поглощают растворимый бикарбонат, выделяя на своей поверхности эквивалентное количество Са (ОН)2.
Выпадение кальция из раствора в результате фотосинтеза получило название биогенной декальцинацией. Основными образователями извести в водоемах России являются рдесты, роголистник, телорез, уруть, элодея, кувшинки, харовые водоросли и другие погруженные растения. Растения при фотосинтезе (в пересчете на 100 кг сухой массы) в течение 10 ч осаждают на своей поверхности до 2 кг извести (Н. П. Воронихин, 1953; К. А. Кокин, 1982). Так, в ряде озер Псковской обл. в зоне произрастания харовых водорослей содержание кальция достигало 32 —37% сухой массы грунта, в озерах Тульской обл. — 52%. По мере удаления от зарослей этих водорослей количество извести резко падает (В. Н. Абрамов, 1959; Д. С. Николаев, 2003). Осаждение кальция на поверхности растений препятствует их росту (А. А. Потапов, 1956).
В то же время ряд растений не способны использовать бикарбонат в больших количествах в качестве источника углерода (рдест плавающий, кубышка, пузырчатка). Такие виды подщелачивают воду незначительно и на их поверхности не откладывается кальций. Они обитают в слабокислых водах, где углекислота имеется в достаточном количестве.
Метан (СН4). Образуется за счет бактериального разложения клетчатки и других органических веществ в толще воды и грунтах пресных водоемов, реже в морях (в основном в анаэробных условиях). Метан — важное звено в круговороте углерода в водных экосистемах. Так, около половины органического углерода, поступающего в донные отложения, выделяется затем в форме метана. Обычно его объем составляет около 30 —50% от всех газов, выделяемых донными отложениями. Скорость образования метана зависит главным образом от количества разлагаемого субстрата и температуры среды. Его концентрация достигает 6— 10 мл/л. Особенно много метана выделяют грунты прудов и озер с высоким содержанием органических веществ и повышенной температурой воды. Так, в водоемах-охладителях тепловых и атомных электростанций выделяется до 300 мл СН4 на 1 м2 в сутки. Нередко можно видеть, как пузырьки метана поднимаются к поверхности воды. Особенно это хорошо заметно на болотах, из-за чего метан называют болотным газом.
Часть образующегося в водоемах метана поступает в атмосферу, часть окисляется микроорганизмами до Н2С03. Количество метанокисляющих бактерий (в основном Pseudomonas) в толще воды достигает сотен клеток в 1 мл воды, а в грунтах — сотен тысяч в 1 г. Эти бактерии могут использовать СН4 даже в очень малых концентрациях, препятствуя его накоплению в толще воды. Для других организмов метан ядовит.
Высшие водные растения с хорошо развитой корневой системой способствуют выносу метана в атмосферу. Установлено, что около 75% СН4, выносимого из литорали озер, удаляется водными растениями (J.W. Decey, M.J. Klug, 1979).
Метан образуется не только на дне водоемов и болот, но и в отстойниках очистных сооружений. Человек давно научился использовать метан, трансформируя органические отходы в биогаз (смесь метана и углекислоты). Содержание метана в биогазе варьирует от 50 до 85% и определяется составом сбраживаемой массы. Так, при распаде жироподобных веществ образуется больше биогаза, причем содержание в нем метана достигает 70%; при сбраживании углеводоподобных соединений доля метана уменьшается до 50%. Присутствие углекислоты снижает теплотворную способность биогаза.
Биогаз получали уже в XIX столетии, и в принципе существенных изменений в технологии за все это время не произошло. Процесс получения биогаза отличается простотой оборудования и доступностью сырья. Он обладает двумя важными преимуществами: во-первых, происходит образование газа, который используется в качестве источника энергии. Во-вторых, оставшиеся отходы являются хорошим удобрением длительного действия.
Технология получения биогаза настолько проста, что во многих странах, расположенных в теплом поясе (в частности, в Китае и Индии), ее применение приобрело массовый характер. В Китае в сельской местности действует около 15 млн дешевых и простых установок вместимостью 10— 15 л, достаточных для удовлетворения энергетических потребностей семьи из нескольких человек. В Индии функционирует несколько миллионов таких установок. В качестве сырья используются навоз и растительные отходы. В среднем 1 кг навоза крупного рогатого скота позволяет получать около 200 л биогаза, навоза свиней — 300 л, птичьего помета — 400 л.
Сбраживание органического субстрата происходит в специальных бродильных камерах (метантенках). Твердые органические отходы предварительно должны быть смочены водой (влажность около 95%). Метантенки представляют собой герметичные сосуды в форме куба или цилиндра. В них помешают сырье, содержащее 2 —12% органического вещества, и герметично закрывают, так как образование биогаза осуществляется в анаэробных условиях.
В процессе сбраживания выделяют две фазы. В первую фазу микроорганизмы, используя органическое вещество, потребляют кислород и создают анаэробные условия. При этом в среде накапливаются органические кислоты, водород и углекислота. Вторая фаза приводит к образованию метана. Метановое брожение осуществляется при 30—40°С (мезофильный процесс) или 50—60°С (термофильный процесс). Последний является наиболее быстрым и эффективным.
В индивидуальных хозяйствах используют метантенки объемом около 1 м3. Промышленные установки достигают объема несколько тысяч кубических метров. Изготавливают их из металла или железобетона. Метантенки снабжены мешалками для перемешивания бродящей массы, что ускоряет процесс образования метана и поддерживает необходимую температуру внутри реактора. Образующиеся газы удаляются через трубку, расположенную в верхней части метантенка.
Скорость процесса определяется температурой ферментации (в термофильных условиях она в 2—3 раза выше, чем в мезофильных), химическим составом сырья, его вязкостью, количеством бактерий и степенью перемешивания. Важным моментом является скорость поступления сырья в реактор или время нахождения в нем.
Чем интенсивнее процесс брожения, тем выше должны быть скорость загрузки сырья в реактор и рентабельнее само производство биогаза. Интенсивно работающий метантенк необходимо перезагружать один раз в 5 — 14 суток, а в среднем — через 10 — 20 дней. Необходимо иметь в виду, что твердые отходы сельскохозяйственного производства (животноводства и растениеводства) сбраживаются медленнее, чем отходы пищевой промышленности.
На интенсивность газообразования большое воздействие оказывают перемешивание и температурный режим. Это связано с тем, что в процессе метанового брожения биогенное разогревание невелико. Поэтому в условиях средней полосы России приходится максимально экономить тепло: метантенки хорошо термоизолируют и немного подогревают. В противном случае значительную часть производимого метана пришлось бы использовать на обогрев самого метантенка. Это является одной из причин, по которой метантенки в домашнем хозяйстве привились прежде всего в тропических областях, где температура воздуха довольно высока.
При существующих ценах на газ производство биогаза вряд ли оправдано, однако в общей системе мероприятий по переработке жидких отходов животноводческих ферм с получением газа и удобрений представляется перспективным.
Сероводород (H2S). Образуется в водоемах при гниении белков и восстановлении сульфатов микроорганизмами. Сероводород даже в самых малых концентрациях вреден для организмов. Кроме того, снижая концентрацию кислорода, идущего на окисление S2- до S, он косвенно отрицательно влияет на их жизнедеятельность.
В морских водоемах в образовании сероводорода участвуют десульфирующие бактерии, восстанавливающие сульфаты воды. Развитию этих бактерий способствуют пониженное содержание 02, застойные зоны на больших глубинах, присутствие в значительных количествах сульфатов. Количество H2S, образованного десульфирующими бактериями (главным образом Desulfovibrio), может быть довольно высоким. Например, в Черном море вся толща воды, за исключением тонкого поверхностного слоя (0—200 м), содержит большое количество сероводорода (до 6 мг/л), поэтому единственными обитателями зараженной зоны являются микроорганизмы.
В пресных водоемах содержание сульфатов невелико. В связи с этим образование H2S за счет жизнедеятельности десульфирующих бактерий наблюдается крайне редко и обычно связано с загрязнением водоемов стоками, содержащими сульфаты.
В пресных водоемах сероводород выделяют гнилостные бактерии, поскольку именно здесь на дне скапливаются разлагающиеся белковые вещества. Значительные количества сероводорода (до 790 мг/л) отмечены на дне водоемов во время их стагнации (А. С. Константинов, 1979).
Освобождение воды от сероводорода осуществляется за счет химического окисления до сульфата и тиосульфата в присутствии кислорода и за счет жизнедеятельности бактерий, главным образом серных. Абиогенное окисление H2S осуществляется в поверхностных слоях воды, где всегда имеется достаточное количество кислорода. Биологическим путем окисляется около трети S2', в основном на границе сероводородной зоны, так как на больших глубинах деятельность серных бактерий подавляется. Помимо серных бактерий сероводород окисляют фотосинтезирующие пурпурные и некоторые зеленые бактерии, используя его в качестве донатора водорода (А. С. Константинов, 1979).