Results and Discussion

По мере накопления мицелия на подложке со временем процесс биосинтеза ферментов начинает угасать, вследствие нехватки кислорода в ограниченном пространстве колбы для культивирования. Для восстановления уровня биосинтеза ферментов с подложки удаляли всю биомассу. На этом заканчивается первый этап процесса, длящийся до 11−14 суток. Ферментативная активность ПГ и ПЛ в КЖ иммобилизованных клеток… Читать ещё >
Results and Discussion (реферат, курсовая, диплом, контрольная)
Изучение роста мицелиальных микроорганизмов и образование ими гидролитических ферментов тесным образом связано с методом их культивирования. При обычном глубинном культивировании свободных клеток микромицетов апикальный характер их роста обусловливает образование массы мицелия растущей в виде шариков (пеллетов). Форма мицелия, образующаяся в процессе глубинного культивирования прямым образом влияет на продуктивность культуры.
Поскольку метоболические реакции зависят от концентрации питательных веществ, те клетки, находящиеся на поверхности мицелиальных шариков имеют максимальный доступ к питательным веществам. Поэтому наиболее продолжительное время максимальный доступ к питательным веществам имеют клетки мицелия, растущие в виде пленки. Пленка в условиях глубинного культивирования превращается в нитчато-губчатую структуру, в которой гифы мицелия растут линейно хорошо доступны питательным веществам и кислороду. Для образования пленки мы создали условия адсорбции посевного материала на поверхности монолитной подложки с большой адсорбционной поверхностью, на которой культура закреплялась и линейно росла вдоль ее поверхности длительное время, в условиях аэрации и механического перемешивания на качалке образуется нитчато-губчатую структуру, которая длительное время продуцирует ферменты.
В наших исследованиях продуцентами ферментов были выбраны микромицеты из рода Aspergillus — Asp. nigerП и Asp.oryzae 3−9-15 — продуценты пектиназы и б-амилазы. Сравнительное изучение образования пектинрасщепляющих ферментов (ПР) и б-амилазы — сврбодными (СК) и иммобилизованными клетками (ИК) показало, что при иммобилизации нитчато-губчатой культуры биосинтез ферментов происходит активно и достаточно длительное время (рис1). Увеличивается стационарная фаза образования ферментов в 2,5−3 раза.
Рисунок 1. — Динамика образования б-амилазы разными структурами мицелия A. awamory 16. 1- массой клеток растущей пеллетами; 2- нитчато-губчатым мицелием иммобилизованным на паралоне.
Свободные клетки имеют ограниченный цикл развития, они образуют максимум ферментов на 3−9 сутки (рис.2−3).
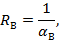
Рисунок 2. — Динамика образования б-амилазы периодической культуры Asp. oryzae 3−9-15. I, 1 — биомасса, г; II, 2 — активность б-амилазы, ед/мл.
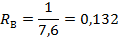
Рисунок 3. — Динамика образования ПР ферментов периодической культуры A. awamory 16. I, 1 — масса сухого мицелия, г; II, 2 — ПкА, ед/мл При последующем культивировании СК, с заменой среды в те же сроки, что и у ИК, происходит автолиз клеток, которой приводит к постепенному падению ферментативной активности культуральной жидкости.
Таким образом, при традиционном методе культивирования выращивание микроорганизмов продолжается 3−4 суток, затем процесс останавливают из-за падения биосинтеза ферментов связанного с лизином культуры. Предложенный нами метод культивирования микроорганизмов продолжается непрерывно на подложке без остановки в течение от 12−15 суток до 2−4 месяцев с многократным получением целевых ферментов через каждые 1−2 суток (табл.1). Если при периодическом культивировании целевой продукт возможно получить только один раз через трое суток, то при иммобилизации целевой продукт получим многократно и непрерывно длительное время через каждые 1−2 суток с получением большего количества культуральной жидкости.
Таблица 1. Характеристика процесса культивирования свободных и иммобилизованных клеток A.awamory 16 на пенополиуретановой подложке.
Параметры культивирования. | Свободные клетки. | Иммобилизованные клетки. |
Продолжительность культивирования, сут. | 60 и более. | |
Объем использованной питательной среды, мл. | ||
Интервалы между получением КЖ и сменой ее на новую порцию питательной среды, сут. | 1−2. | |
Сумма получаемой КЖ, мл. | ||
Суммарное количество ферментов через 60 суток культивирования у иммобилизованной культуры в 4600 мл, ПГ активность по редуцирующим веществам, ед/мл. | ; | 16 468. |
ПЛ, ед/мл. | ; | 55 660. |
Суммарное количество фермента у свободных клеток за 3 сут ПГ, ед/мл ПЛ, ед/мл. |
|
|
По мере накопления мицелия на подложке со временем процесс биосинтеза ферментов начинает угасать, вследствие нехватки кислорода в ограниченном пространстве колбы для культивирования. Для восстановления уровня биосинтеза ферментов с подложки удаляли всю биомассу. На этом заканчивается первый этап процесса, длящийся до 11−14 суток. Ферментативная активность ПГ и ПЛ в КЖ иммобилизованных клеток соответственно выше, чем в КЖ свободных клеток в 2 и 6 раз (таблица 2). Кроме того, в условиях периодического культивирования свободных клеток максимум образования ферментов наблюдается на 3 сутки, тогда как у иммобилизованных клеток стабильно высокие показатели зафиксированы на 11−14 сутки.
Таблица 2. Активность пектинрасщепляющих ферментов свободных и иммобилизованных клеток у A.awamori 16 (на третьи сутки культивирования после снятия мицелия с подложки).
фермент. | Свободные клетки. | Иммобилизованные клетки. |
ПГ активность по редуцирующим веществам, ед/мл. | 1,54. | 5,5. |
ПГ активность по вязкости, ед/мл. | 1,8. | 3,58. |
ПМЭ, ед/мл. | 0,22· 103 | 0,13· 103 |
ПЛ, ед/мл. | 2,0. | 12,1. |
Пектинрасщепляющая активность (ПкА), ед/мл. | 18,0. | 120,0. |
После удаления мицелия с подложки начинается второй этап процесса биосинтеза, для начала которого характерно падение активности КЖ. Через 2−4 сут после снятия мицелия даже следовые количества старых клеток, оставшихся в порах носителя, способны продуцировать столько фермента, сколько 2−3 г молодого мицелия на первом этапе культивирования, а именно 60−80 ед/мл КЖ при продуктивности культуры 20−30 ед/г мицелия. Далее, закономерности, наблюдаемые на первом этапе, повторяются и на втором. На третьем этапе активность увеличивается в 10−12 раз по сравнению с таковой периодической культуры. В процессе многоэтапного культивирования наблюдали стабильно увеличивающуюся продуцирующую способность культуры, которая сохраняется на протяжении всего срока культивирования — в течение 60 сут (рис 4).
Таким образом, при иммобилизации A.awamori 16 имеет место повышение активности ферментов КЖ от 2 до 6 раз на первом этапе и в 10−12 раз на третьем, а также удлинение фазы активного образования ферментов по сравнению с периодической культурой с 3 до 11−14 сут. Кроме активации культуры наблюдали стабилизацию продуцирующей способности гриба, которая сохраняется на протяжении всего срока культивирования (60 сут). Частота получения целевого продукта постепенно увеличивается. Если при периодическом культивировании целевой продукт получали на третьи сутки, то при иммобилизации — через 1−2 сут в зависимости от количества агрегированного мицелия.
культивирование новый метод микромицет.
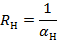
Рисунок 4. — Динамика продуктивности иммобилизованной культуры A. awamory 16.
Наиболее информативными критериями промышленного производства любого биологически активного вещества, в том числе и ферментов, являются удельная продуктивность и объемная производительность клеток. Показатели по обоим параметрам у иммобилизованных клеток выше, чем у свободных в 2−6 раз (табл. 3, 4). Удельная продуктивность иммобилизованных клеток, также как и активность ПР ферментов, возрастает по сравнению с соответствующими показателями культуры свободных клеток в 1,5−6 раз (см. табл. 3). В табл.5 приведены данные о преимуществах культивирования микромицетов в иммобилизованном состоянии.
Таблица 3. Удельная продуктивность свободных и иммобилизованных клеток A.awamori 16 (на третьи сутки культивирования).
Фермент. | Активность фермента на 1 г биомассы за 1 сут, ед/мл. | |
Свободные клетки. | Иммобилизованные клетки. | |
ПГ по редуцирующим веществам. | 44,63. | 146,32. |
ПГ по вязкости. | 52,17. | 97,41. |
ПМЭ. | 0,63· 103 | 3,54· 103 |
ПЛ. | 45,97. | 329,2. |
ПкА. | 521,7. | 3265,3. |
Таблица 4. Объемная производительность иммобилизованной культуры A.awamori 16 (через 60 сут культивирования в 4600 мл КЖ) и свободных клеток (через трое суток в 100 мл КЖ).
Фермент. | Ферментативная активность клеток. | |||
Свободных. | Иммобилизованных. | |||
в 100 мл. | в 4600 мл. | в 100 мл. | в 4600 мл. | |
ПГ активность по редуцирующим веществам, ед/мл. | 154,0. | 8 310. | 25 300. | |
ПГ активность по вязкости, ед/мл. | 180,0. | 9 720. | 16 468. | |
ПМЭ, ед/мл. | 2,2· 10-3 | 118,8· 10-3 | 13· 10-3 | 598· 10-3 |
ПЛ, ед/мл. | 200,0. | 10 800. | 1210,0. | 55 660. |
Пектинрасщепляющая активность (ПкА), ед/мл. | 180,0. | 9 700. | 12 000,0. | 552 000,0. |
Таблица 5. Параметры культивирования иммобилизованных и свободных клеток A.awamori 16 (в течение 60 суток).
Параметры культивирования. | Свободные клетки. | Иммобилизованные клетки. |
Количество КЖ, мл. | ||
Количество необходимых пассажей. | ||
Стоимость посевного материала одной пробирки сусло-агара, руб. | 0,2. | 0,01. |
Количество фермента, г. | 6,8. | 18,7. |
Активность КЖ по ПГ, ед/мл. | 25 300. | |
Активность КЖ по ПЛ, ед/мл. | 10 800. | 55 600. |
Операции по фильтрации КЖ. | Фильтрация необходима. | Фильтрация исключается. |
Экономия времени и средств по стерилизации аппаратуры, кратность. | ; | |
Присутствие спор в воздухе. | Присутствуют. | Отсутствуют. |
Время получения активной КЖ, сут. | 1−2. |
Наблюдаемые увеличение ферментативной активности КЖ на всех этапах культивирования иммобилизованной биомассы, удлинение фазы активного ферментообразования с 3 до 11−14 сут, новый тип кривой динамики продуктивности культуры, объясняются тем, что иммобилизация создает благоприятные условия для формирования селективных культур активность которых превышают исходную в 10 раз.
На основании разработанного метода длительного культивирования микромицетов был отобран новый способ селекции микроорганизмов без использования мутагенов физической и химической природы. Сущность разработанного метода селекции заключается в формировании множества различных вариантов на подложке при длительном выращивании микроорганизмов иммобилизованных на подложке, среди которых образуется и высокоактивный. Предпосылкой для формирования активного варианта являются стрессы, которые испытывает культура в процессе длительного выращивания. Это механическое повреждение гиф при удалении скапливающегося мицелия с подложки, условия смены питательной среды — обедненой на полноценную и сам процесс длительного культивирования. Для выявления активного варианта отбираются изоляты в разные периоды культивирования для анализа способности на образования того или иного фермента. Выявленные селективные культуры превышали по ферментативной активности исходные культуры в десятки раз. Так была получена высокоактивная культура продуцента пектинлиазы — P.cyclopium, превышающее исходную в 30 раз.
Применение адсорбционной иммобилизации по разработанному методу обеспечивает существенные преимущества культивирования продуцента в иммобилизованном состоянии по сравнению с традиционным процессом микробного синтеза на основе свободных клеток в периодических условиях культивирования. При этом продуктивность культуры возрастает в среднем в 4 раза, срок культивирования продуцента — в 20 раз, удлиняется стадия активного ферментообразования, обеспечивается многократность использования первоначально иммобилизованной культуры.
Кроме того, экономится сырье на приготовление сред и посевного материала, а также трудовые затраты — исключаются операции по перезарядке ферментационных сосудов, связанные с удалением биомассы из системы. Упрощаются процессы выделения ферментов за счет того, что КЖ не требует фильтрации вследствие иммобилизации биомассы на подложке. По этой же причине в системе присутствует только вегетативный мицелий. Отсутствие спор при культивировании вегетативного иммобилизованного мицелия сохраняет чистоту воздуха. Все эти преимущества иммобилизации микромицетов могут существенно сказаться на общей экономике и культуре процесса биосинтеза ферментов, а также резко снизить себестоимость продукта.