Кинетика ферментативных реакций.
Уравнения Михаэлиса — Ментен и Моно — Иерусалимского

В частности, водородпероксид Н2О2, образующийся как побочный интермедиат при внутреннем дыхании клеток, разрушается типичным ферментом — каталазой. При отсутствии каталазы водородпероксид разлагается медленно и накапливается в значительных количествах. Водородпероксид взаимодействует с биоорганическими веществами клетки, окисляет их, что может привести к гибели клетки. Это свойство… Читать ещё >
Кинетика ферментативных реакций. Уравнения Михаэлиса — Ментен и Моно — Иерусалимского (реферат, курсовая, диплом, контрольная)
Подавляющее большинство реакций, протекающих в живых организмах, осуществляется при участии биологических катализаторов, которые имеют общее название ферменты. Характерная особенность ферментов — их специфичность, под которой понимается свойство ферментов изменять скорость одних реакций, не влияя на скорости других реакций, протекающих в клетке.
Катализом называется селективное изменение скорости химической реакции веществом, участвующим в реакции, количество и состав которого не меняются к моменту образования конечных продуктов. Вещество, обладающее указанными свойствами, называется катализатором.
Различают два типа катализа: положительный (скорость реакции возрастает) и отрицательный (скорость реакции уменьшается).
Реакции, скорость которых изменяется под действием продукта, называются автокаталитическими.
Обычно термин «катализ» относят к положительному катализу. В этом смысле данный термин будет применяться ниже.
В частности, водородпероксид Н2О2, образующийся как побочный интермедиат при внутреннем дыхании клеток, разрушается типичным ферментом — каталазой. При отсутствии каталазы водородпероксид разлагается медленно и накапливается в значительных количествах. Водородпероксид взаимодействует с биоорганическими веществами клетки, окисляет их, что может привести к гибели клетки. Это свойство водородпероксида используется для уничтожения патогенных микроорганизмов при обработке свежих ран.
В состав каталазы, как и в состав большинства ферментов, входит ион металла, поэтому эти катализаторы называют металлоферментами. Химический анализ показывает, что в каждой молекуле каталазы имеется ион железа Fe, Именно ионы железа Fe2* ускоряют разложение водородпероксида. Однако существенным отличием является то, что в присутствии каталазы водородпероксид разлагается гораздо быстрее, чем при таком же количестве соли железа (II).
Разложение водородпероксида 2Н2О2 —> 2Н20 + 02 как с наличием указанных катализаторов, так и при их отсутствии протекает по закону первого порядка относительно водородпероксида. В табл. 6.1 приведены соответствующие значения констант скорости реакции первого порядка к при комнатной температуре, молярной концентрации катализаторов и энергии активации.
При данных условиях разложение водородпероксида в присутствии ионов железа Fe2* происходит примерно в 105 раз, а в присутствии каталазы — в Ю10 раз быстрее, чем некаталитическое разложение.
Таблица 6.1. Значения констант скорости реакции первого порядка молярной концентрации и энергии активации при комнатной температуре.
Катализатор | Сот, моль/л. | к1у с" 1 | Е" кДж/моль. |
Нет. | 110-6 | ||
Fe2" . | 0,01. | 6 10 2 | |
Каталаза. | 0,01. | 41 O'4 |
Изучение зависимости скорости реакции субстрата от температуры показывает, что ускоряющее действие катализаторов связано с существенным уменьшением энергии активации Еа соответствующего превращения.
Так, например, в случае водородпероксида (см. табл. 6.1) при некаталитическом разложении Еа = 75 кДж/моль. В присутствии ионов железа Fe2+ Еа = 7 кДж/моль, т. е. значение энергии снижается более чем в 10 раз по сравнению со значением энергии при разложении водородпероксида при отсутствии катализаторов. Уменьшение энергии активации, как это следует из уравнения Аррениуса (6.15), увеличивает скорость реакции. При комнатной температуре изменение величины Еа на 6 кДж/моль соответствует изменению скорости примерно в 10 раз.
Возникает вопрос: чем обусловлено уменьшение энергии активации в присутствии катализатора? Чтобы ответить на этот вопрос, необходимо более подробно рассмотреть особенности кинетики каталитических реакций, в частности ферментативного катализа.
Если изобразить кинетические реакции субстрата в присутствии фермента в виде кривой, то можно выделить три участка (рис. 6.7). На участок I приходится лишь незначительная часть общего времени протекания реакции — порядка нескольких миллисекунд. Этот участок называется переходным: скорость меняется от нуля до некоторого стационарного значения v" (см. рис. 6.7, б). На участке II скорость примерно постоянна и равна в течение нескольких минут. Участок II называется стационарным, ему приблизительно соответствует прямолинейный отрезок кинетической кривой. На участке III скорость реакции монотонно падает до нуля вследствие израсходования субстрата. На данный участок приходится наибольшая часть времени протекания реакции — порядка нескольких десятков минут. В связи с этим участок III называется основным.
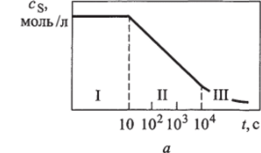
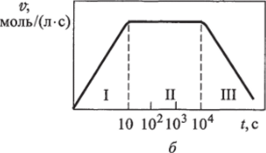
Рис. 6.7. Зависимости концентрации субстрата cs (а) и скорости реакции V (6) от времени:
I, II, III — переходный, стационарный и основной участки Общая форма кинетической кривой (см. рис. 6.7, а), описывающей ферментативный катализ, имеет S-образный характер, типичный для последовательных реакций (см. рис. 6.5). Такое сходство позволяет предположить, что в ходе ферментативной реакции субстрат образует некоторый интермедиат. Тщательное изучение кинетики ферментативных реакций подтверждает высказанное предположение: во всех ферментативных реакциях субстрат S образует с молекулой фермента Е соединение ES, которое называется фермент-субстратным комплексом. Фермент-субстратный комплекс может распадаться по двум путям. При распаде по первому пути вновь формируются исходные молекулы субстрата S и фермента Е. При распаде по второму пути происходит образование молекулы продукта Р и регенерация молекулы фермента Е.
Таким образом, механизм ферментативного катализа описывается следующими стадиями:
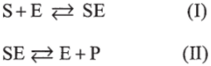
Впервые доказательства рассмотренного механизма действия ферментов получили Л. Михаэлис и М. Ментен в 1913 г. Эти же ученые вывели формулу зависимости стационарной скорости vCT ферментативной реакции от концентрации субстрата (уравнение Михаэлиса — Ментен): где cs — концентрация субстрата в начале участка И кинетической кривой (см. рис. 6.7, а); цтах — максимальная скорость; Ки и cs — постоянные величины для данных фермента и субстрата. Дальнейшую разработку, связанную с ферментативной кинетикой, провели Моно и Иерусалимский.
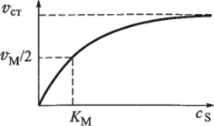
Рис. 6.8. Зависимость стационарной скорости ферментативной реакции от концентрации с$ субстрата.

Особенности зависимости стационарной скорости аст от концентрации.
cs субстрата (рис. 6.8) можно установить следующим образом.
При малых концентрациях субстрата (cs <�к АТМ) величиной cs в знаменателе выражения (6.16) можно пренебречь. Тогда зависимость стационарной скорости от концентрации Cs принимает вид.

т. е. скорость «ст пропорциональна концентрации cs. В соответствии с таким характером зависимости начальный участок кривой представляет собой прямую линию с тангенсом угла наклона, равным с5» Км.
При больших концентрациях субстрата (c.s «АГМ) в знаменателе выражения (6.16) можно пренебречь величиной Км, в связи с чем запишем.

Из выражения (6.18) следует, что при больших концентрациях субстрата скорость достигает максимального значения, равного «тах, и не зависит от величины cs. Соответственно участок кривой на рис. 6.8 при больших значениях cs представляет собой прямую, параллельную оси абсцисс.
Если для некоторого фермента экспериментально изучена зависимость стационарной скорости ферментативной реакции от концентрации с$ этого субстрата (см. рис. 6.8), то нетрудно определить численные значения постоянных Км и ^тах.
Как это было показано выше, величина г;тах равна максимально возможной скорости реакции превращения субстрата при данной концентрации фермента.
Из выражения (6.16) ясно, что постоянная Км численно равна такой концентрации субстрата, при которой стационарная скорость соответствует половине максимальной. Эта величина получила название константы Михаэлиса (см. рис. 6.8).
Наблюдаемую зависимость стационарной скорости пст ферментативной реакции от концентрации легко объяснить, исходя из механизма ферментативного катализа.
Очевидно, что скорость превращения субстрата с образованием продукта Р пропорциональна концентрации фермент-субстратного комплекса (стадия II). При малых концентрациях субстрата в растворе имеется некоторое число свободных молекул фермента Е, не связанных в фермент-субстратный комплекс SE. Поэтому при повышении концентрации субстрата концентрация комплексов возрастает (стадия I) и соответственно возрастает скорость реакции.
При больших концентрациях субстрата практически все молекулы фермента связаны в фермент-субстратные комплексы SE. В связи с этим дальнейшее увеличение концентрации субстрата практически не повышает концентрации комплексов и, следовательно, скорость реакции остается постоянной.
Образование фермент-субстратных комплексов также позволяет объяснить снижение энергии активации превращения субстрата (см. табл. 6.1). Связывание в комплекс приводит к перераспределению электронов в молекуле субстрата, что, в свою очередь, уменьшает прочность разрываемых связей и соответственно энергию активации.
Рассмотренные в разд. 6.6 примеры наглядно показывают, как на основе кинетических закономерностей с привлечением термодинамики можно прогнозировать протекание во времени химических реакций, в том числе и биохимических превращений.