Уравнения односторонних реакций нулевого, первого и второго порядков

Для получения зависимости С от Т для реакций всех порядков надо проинтегрировать соответствующее дифференциальное уравнение ((15.5)—(15.10)) при начальном условии: С= С0 при t = 0. Из уравнения следует, что концентрация реагирующего вещества линейно убывает со временем. Размерность константы скорости равна размерности скорости реакции. Если проводить эту реакцию при близких концентрациях… Читать ещё >
Уравнения односторонних реакций нулевого, первого и второго порядков (реферат, курсовая, диплом, контрольная)
Рассмотрим зависимость концентрации реагирующих веществ С от времени t для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Для получения зависимости С от Т для реакций всех порядков надо проинтегрировать соответствующее дифференциальное уравнение ((15.5)—(15.10)) при начальном условии: С= С0 при t = 0.
Реакции нулевого порядка
Подставим в уравнение (15.5) выражение (15.2), с учетом того, что расчет ведется по исходному веществу, А (что обусловливает выбор знака «-»):
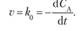
После разделения переменных и интегрирования в пределах времени от 0 до t и концентраций — от С0 до С получаем.
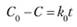
или.
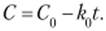 (15.11).
(15.11).
Из уравнения следует, что концентрация реагирующего вещества линейно убывает со временем. Размерность константы скорости равна размерности скорости реакции.
Подставляя в это выражение 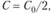 найдем время, за которое прореагирует половина исходного вещества,
найдем время, за которое прореагирует половина исходного вещества, 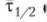 'время полупревращения)'.
'время полупревращения)'.
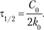 (15.12).
(15.12).
Реакции первого порядка
Подставим в уравнение (15.6) выражение (15.2):
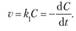
Интегрирование даст.
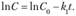
(15.13).
Следовательно, константа скорости первого порядка имеет размерность, обратную времени (с-1).
Подставляя С = С()/2, найдем время полупревращения:
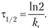
(15.14).
Значит, время полупревращения для реакций первого порядка не зависит от исходной концентрации реагирующего вещества.
Из уравнения (15.13) следует линейная зависимость логарифма концентрации от времени. Отсюда можно определить константу скорости (рис. 15.6), используя экспериментальные данные.
Логарифм концентрации для реакции первого порядка линейно зависит от времени, и константа скорости численно равна тангенсу угла наклона прямой к оси времени (см. рис. 15.6):
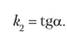
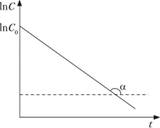
Рис. 15.6. Зависимость логарифма концентрации от времени для реакций первого порядка.
Реакции второго порядка
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (15.7). В этом случае с учетом формулы (15.2) можно записать.
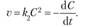
После разделения переменных и интегрирования при граничных условиях времени от 0 до t и концентраций от С0 до С получаем.
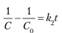
или.
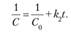 (15.15).
(15.15).
Подставляя С = С0/2, найдем время полупревращения.
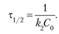 (15.16).
(15.16).
Таким образом, время полупревращения для реакций второго порядка обратно пропорционально исходной концентрации реагирующего вещества С0.
Для реакций второго порядка характерна линейная зависимость обратной концентрации от времени (рис. 15.7), и константа скорости равна тангенсу угла наклона прямой к оси времени:

Рис. 15.7. Зависимость обратной концентрации от времени для реакций второго порядка.
Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата):
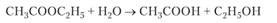
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум, и кинетическое уравнение имеет следующий вид:
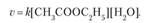
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
- 1) избыток воды:
- 2)
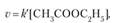
здесь.
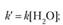
2) избыток этилацетата:
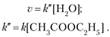
В этих случаях мы имеем дело с реакцией псевдопервого порядка. Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.