Сложные белки.
Биохимия

Липопротеины составляют большую группу сложных белков. Эти макромолекулы в значительных количествах находятся в митохондриях, из них в основном состоит эндоплазматический ретикулум, их обнаруживают и в плазме крови, и в молоке. Как правило, липопротеины — это большие молекулы. Их молекулярная масса достигает миллиона дальтон. Гидрофильность белковой и гидрофобность простетической групп… Читать ещё >
Сложные белки. Биохимия (реферат, курсовая, диплом, контрольная)
Как правило, эти белки классифицируют по небелковому компоненту.
Липопротеины составляют большую группу сложных белков. Эти макромолекулы в значительных количествах находятся в митохондриях, из них в основном состоит эндоплазматический ретикулум, их обнаруживают и в плазме крови, и в молоке. Как правило, липопротеины — это большие молекулы. Их молекулярная масса достигает миллиона дальтон. Гидрофильность белковой и гидрофобность простетической групп липопротеинов определяют ту роль, которую они играют в процессах избирательной проницаемости. Липиды, входящие в состав липопротеинов, отличаются по строению и биологическим свойствам. В частности, в составе липопротеинов открыты нейтральные липиды, фосфолипиды, холестерин и др. Липидный компонент соединяется с белком при помощи нековалентных связей различной природы. Так, нейтральные липиды соединяются с белком посредством гидрофобных связей. Если же в образовании липопротеина участвует фосфолипид, то он взаимодействует с белком при помощи ионных связей.
Гликопротеины — содержат в своем составе гликозидные компоненты различной природы, ковалентно связанные с белком. Небольшие олигосахаридные группы могут присоединяться к белкам через О-гликозидную связь к гидроксилам остатков серина или треонина, а также через N-гликозидную связь к внешней поверхности животных клеток, являются гликопротеинами. В плазме крови также содержится большое количество гликопротеинов. Следует отметить группу гликозамингликанов, в которых в качестве небелкового компонента находятся кислые мукополисахариды. Содержание углеводного компонента в гликопротеинах варьирует в широких пределах (от 1 до 30% массы всей молекулы). Более того, на одну полипептидную цепь может приходиться несколько линейных или разветвленных углеводных цепей.
В углеводном компоненте гликопротеинов обнаружены такие моносахариды, как D-галактоза, D-манноза, D-глюкоза, УУ-ацетилгалактозамин, Л^-ацетилглюкозамин и др.
Фосфопротеины в качестве простетической группы содержат ортофосфорную кислоту, связанную с гидроксилом серина или треонина. К фосфопротеинам относятся многие питательные белки, например основной белок молока — казеин, который кроме фосфорной группы имеет также в своем составе углеводный компонент. Белок яичного желтка — вителлин, икры рыб — ихтулин.
Хромопротеины — сложные белки, в состав которых входят окрашенные небелковые компоненты. Наиболее распространенными представителями хромопротеинов являются флавопротеины, у которых в качестве небелковых компонентов включены флавинмононуклеотид и флавинадениндинуклеотид, а также гемопротеины, красное окрашивание которых обусловлено наличием гема с включенным в него железом. Этот пигмент представляет собой плоскую структуру, состоящую из четырех пиррольных колец, в центре координации которых находится атом железа. Координационное число железа в составе гема равно 6, причем четыре связи заняты азотами пиррольных колец, пятая связывает гем с белком, а шестая — занята тем или иным лигандом. Пиррольные кольца соединены метановыми мостиками, образуя тетрапиррольное кольцо, к которому присоединены винильные, метильные и пропионатные группировки (рис. 3.16).
Гем является простетической группой всего семейства гемопротеинов, наиболее известный представитель которых гемоглобин переносит кислород от альвеол легких к тканям.
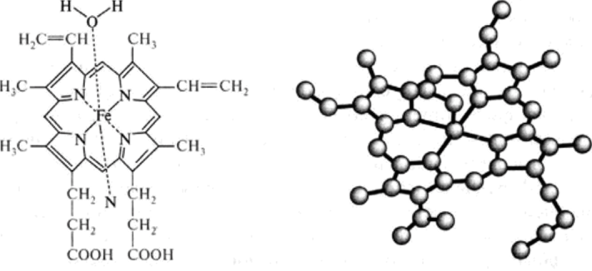
Рис. 3.16. Строение гема.
Вес гемоглобины независимо от источника получения образуют четвертичную структуру и состоят из четырех субъединиц, представляющих две идентичные пары типа: а2р2. Интересно отметить, что аи p-цепи имеют высокую (более 50%) степень гомологии. Четыре полипептидных цепи образуют тетраэдр, структура которого стабилизирована множественными нековалентными связями. Каждая полипептидная цепь определенным образом уложена вокруг плоского кольца гема, причем характер этой укладки достаточно консервативен, т. с. почти одинаков для всех гемоглобинов. Первичная структура гемоглобина была расшифрована в 1962 г. Г. Браунитцером, а пространственная структура М. Перутцем и соавторами годом раньше. У млекопитающих а-цепи гемоглобина отличаются от (3-цепей как по числу аминокислотных остатков, так и, но степени гомологии (различия примерно по 80 аминокислотам). Гем локализован в складках аи р-субъединиц, каждая полипептидная цепь при этом содержит один гем. Тетрамер гемоглобина представляет собой почти правильную глобулярную структуру размером 64×60×50 нм, на поверхности которой в гидрофобных углублениях расположены гемы.
Идентичные субъединицы в тетрамере расположены параллельно друг другу и почти перпендикулярно по отношению к другой паре субъединиц. Присоединение гема к глобину вызывает изменения в структуре последнего, причем увеличивается степень спирализации, формируются дополнительные связи между отдельными субъединицами, т. е. макромолекула становится более стабильной. Связи между идентичными субъединицами, как правило, неполярны, хотя наблюдаются единичные солевые мостики. Образование связей в гемоглобине имеет обратимый характер, причем присоединение к железу гема того или иного лиганда также влияет на способность аи p-цепей контактировать друг с другом. Так, если а,-субъединицу считать фиксированной в пространстве, то а2-цепь при присоединении лиганда поворачивается на 16° и сдвигается на 2,1 нм; р2-субъединица поворачивается на 13,5° и смещается на 1,9 нм. При присоединении молекулы кислорода к гемоглобину происходит ряд существенных структурных перестроек последнего, облегчающих присоединение следующих молекул кислорода. В дезоксигемоглобине железо не находится строго в плоскости пиррольных колец, а смещено на 0,25 нм. Молекула кислорода после контакта с гемоглобином проникает вовнутрь геминового кармана и взаимодействует с железом. В результате железо гема перемещается точно в плоскость протопорфиринового кольца, что приводит к соответствующему смешению гистидинового остатка, соединенного с железом, и всей полипептидной цепи, в которой он локализован. Изменения в одной субъединице молекулы гемоглобина обусловливают соответствующие изменения других субъединиц, выгодные для присоединения молекул кислорода. Таким образом, присоединение первой молекулы кислорода происходит достаточно медленно и обязательно при высоком парциальном давлении кислорода, что и имеет место в альвеолах легких. Далее скорость присоединения кислорода к гемоглобину увеличивается по нарастающей и скорость присоединения четвертой его молекулы выше, чем первой, более чем в 300 раз. Таким образом, реализуется кооперативный эффект взаимодействия гемоглобина с кислородом, что обеспечивает максимальное образование оксигемоглобина. Четвертичная структура дезоксигемоглобина обозначается как Т-форма (Tense — напряженная), а структура оксигемоглобина — как R-форма (Relaxed — релаксированная). Миоглобин, состоящий из одной полипсптидной цепи, также присоединяет кислород в тканях, однако отсутствие четвертичной структуры является препятствием для реализации кооперативного эффекта, поэтому кривые насыщения гемоглобина и миоглобина имеют различную форму (рис. 3.17).
Парциальное давление кислорода максимально в легких и минимально в других различных тканях организма. Из представленных кривых (рис. 3.17) видно, что сродство миоглобина к кислороду выше, чем гемоглобина. Следующее различие заключается в том, что кривая насыщения кислородом в случае миоглобина имеет гиперболическую форму, а для гемоглобина — сигмоидную.
Способность гемоглобина связывать кислород зависит от ряда факторов. Было обнаружено, в частности, что на связывание гемоглобином кислорода большое влияние оказывает pH среды и содержание С02. В тканях, где значение pH несколько меньшее по сравнению с легкими, а концентрация С02 достаточно высока, сродство гемоглобина к кислороду снижается, кислород отделяется, а С02 и протон водорода присоединяются к гемоглобину. Напротив, в альвеолах легких при освобождении С02 происходит повышение pH и сродство гемоглобина к кислороду увеличивается (рис. 3.18). Этот феномен называется эф<�ректом Бора в честь ученого, впервые открывшего это явление. В реализации данного эффекта кроме гемоглобина и кислорода участвуют С02 и протон водорода. Дезоксигемоглобин представляет собой протонированную форму пигмента. Реакцию оксигенации можно записать следующим образом:
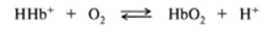
причем направление реакции зависит от концентрации ионов водорода. В эритроцитах присутствует еще один регулятор сродства гем глобина к кисло;
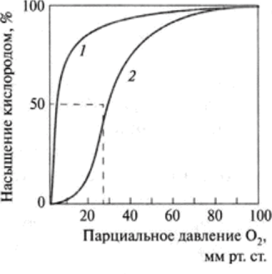
Рис. 3.17. Кривые насыщения кислородом:
/ — миоглобин; 2— гемоглобин.
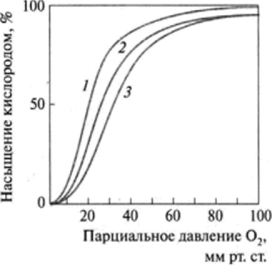
Рис. 3.18. Влияние pH на сродство кислорода к гемоглобину:
/ - pH 7,6; 2 — pH 7.4; 3 — pH 7,2 (при pH 7.2. характерном для тканей, сродство кислорода к гемоглобину заметно меньше, чем в легких, для которых pH равно 7,6).
роду. Это 2,3-дифосфоглицерат, который избирательно взаимодействует с дезоксигемоглобином, что приводит к стабилизации его структуры, а именно Т-формы. Это, в свою очередь, понижает сродство к кислороду и способствует его высвобождению при более низком парциальном давлении.