Стационарные режимы горения в гомогенном химическом реакторе

Дифференцируя данное уравнение по Т и удовлетворяя условию dG/dT = 0, получим квадратное уравнение относительно Г, из которого с точностью до малых второго порядка по параметрам RT0/E, RTb/E следует Итак, разогрев газа на величину, превышающую характеристический интервал, приводит, как и в теории теплового взрыва, к самовоспламенению. В режиме горения понижение температуры газа на такую же… Читать ещё >
Стационарные режимы горения в гомогенном химическом реакторе (реферат, курсовая, диплом, контрольная)
В стационарных условиях скорость поступления реагирующего вещества в реакционный сосуд равна сумме скорости потребления вещества в ходе химической реакции и скорости выноса вещества с отходящими газами:
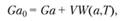 (3.104).
(3.104).
где а — относительная весовая концентрация реагирующего вещества, ее удобно использовать, поскольку в реакторе сохраняется полный массовый поток G (в r/сек); V — объем реактора. Подчеркнем еще раз, что концентрация и температура уходящего газа совпадают со значениями, а и Г в реагирующем газе и что реактор — широкая труба с нулевым гидродинамическим сопротивлением.
Уравнение тепловою баланса в отсутствие тепловых потерь может быть записано в виде равенства потока энергии, поступающего в реактор, и потока энергии, отводимого из него:
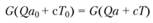 (3.105).
(3.105).
(с — теплоемкость при постоянном давлении).
Используя это соотношение между текущими значениями концентрации и температуры и задавая выражение аррениусовского типа для скорости химической реакции, представим уравнение (3.104) в виде.
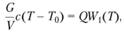 (3.106).
(3.106).
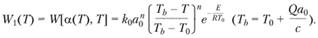
Функция тепловыделения QW1(T) представлена на рис. 3.19. Графически решения уравнения (3.106) можно найти, определив точки пересечения этой кривой с прямыми теплоотвода, наклон которых зависит от времени пребывания частицы вещества в сосуде, обратно пропорционального отношению G/V. Эти прямые могут располагаться относительно кривой тепловыделения тремя способами.
- 1. При большой скорости потока (прямая 1) струя успевает уносить тепло, выделяющееся в реакции. В этом случае возможен только один стационарный режим, характеризующийся малым разогревом смеси. Реакция идет с небольшой скоростью, и выгорание очень мало.
- 2. Если, напротив, скорость струи мала (прямая 3), то среднее время пребывания частицы в сосуде больше периода индукции химической реакции, и реализуется один стационарный режим с большой температурой, близкой к 7},. Скорость химической реакции при этом не очень большая, поскольку процесс происходит при почти полном выгорании реагирующего вещества.
- 3. При промежуточных значениях скорости струи в довольно широком интервале ее изменения кривая тепловыделения пересекается с прямой теплоотвода (прямая 2) в трех точках.
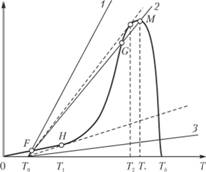
Рис. 3.19. Зависимости скорости тепловыделения (кривая FHGM) и скорости теплоотвода (прямые 1−3) от температуры в гомогенном химическом реакторе (пунктиром нанесены прямые теплоотвода, касающиеся кривой тепловыделения).
Средняя точка пересечения G соответствует неустойчивому режиму, поскольку достаточно лишь небольшого изменения состояния системы, чтобы вследствие нарушения равенства теплоприхода и теплорасхода произошел переход в точку F или точку М, которые являются устойчивыми.
Режим, отвечающий точке F, представляет собой медленную реакцию при температуре, близкой к температуре стенок сосуда. Граница существования этого режима по своему физическому смыслу совпадает с пределом теплового взрыва в теории Н. Н. Семёнова. Действительно, при увеличении времени пребывания, что эквивалентно в теории теплового взрыва уменьшению теплоотдачи, происходит сближение точек F и G, и, наконец, после касания в точке Я стационарный режим с малым разогревом становится невозможным — происходит самовоспламенение. Нетрудно убедиться, что максимально возможный разогрев смеси, как и в теории ?. Н. Семёнова, равен характеристическому интервалу температур 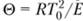 .
.
Однако имеются и существенные различия между самовоспламенением в струе и замкнутом сосуде. В теории теплового взрыва отсутствие самовоспламенения объясняется интенсивным теплообменом горючей смеси с окружающей средой. В случае же проточного химического реактора собственная теплоемкость реагирующего газа обусловливает отсутствие самовоспламенения при большой скорости струи даже при адиабатических условиях протекания реакции.
Еще одно различие связано с учетом выгорания. В теории теплового взрыва учет выгорания реагирующего вещества приводит к тому, что переход от реакции с малым разогревом к воспламенению оказывается плавным — даже при достаточно больших энергии активации и теплоте реакции этот переход совершается, хотя и при весьма малом, но все же конечном изменении параметров. При изучении процессов в гомогенном химическом реакторе идеального перемешивания выгорание учитывается с помощью использования связи (3.105) между концентрацией и температурой. Поэтому переход между самовоспламенением и стационарным низкотемпературным режимом отвечает строго скачкообразному поведению реакции: как бы мало мы не перешли предел, в струе произойдет воспламенение. Физически это связано с тем, что в струе с непрерывной подачей вещества мы можем предоставить системе неопределенно долгое, не лимитированное выгоранием время для выявления стационарности или нестационарности режима; поэтому и существуют режимы реакции, абсолютно резко (а не асимптотически, приближенно!) отделенные друг от друга.
Построим по данным рис. 3.19 зависимость температуры газа в реакторе от массового расхода газа G (рис. 3.20).
При больших скоростях возможен один режим с малой скоростью реакции при температурах, близких к T0. По мере уменьшения скорости струи температура, при которой идет реакция, нарастает, но, как это видно на рис. 3.19, очень незначительно. Начиная со значения скорости струи, равного G2, при котором прямая теплоотвода (верхняя пунктирная прямая на рис. 3.19) касается кривой тепловыделения, возможны, вообще говоря, два устойчивых режима — один с большой (точка М на рис. 3.19), другой с малой (точка F на рис. 3.19) скоростью реакции. Осуществление того или другого из этих двух режимов зависит от того, в каких условиях находилась смесь в сосуде. Если смесь горела при высоких температурах (малые G) и мы перешли в рассматриваемую область постепенным увеличением скорости струи, то осуществится тот режим, который соответствует более высокой температуре (верхняя ветвь кривой рис. 3.20). Если же соответствующие условия для протекания горения созданы уменьшением G от тех значений, при которых реакция идет при температурах, близких к T0, то будут осуществляться состояния, описываемые нижней ветвью кривой рис. 3.20. Для того чтобы перейти от одного режима к другому, можно воспользоваться двумя способами. Либо надо так изменить скорость струи или температуру, чтобы тот режим, который мы хотим осуществить, оказался единственно возможным, либо при данной скорости струи очень сильно изменить температуру T0 (параллельное перемещение прямых теплоотвода на рис. 3.19).
Рисунок 3.20 показывает неоднозначный, гистерезисный характер процессов в гомогенном химическом реакторе идеального перемешивания. При постоянной начальной температуре газа Т0 переход от низкотемпературного режима к верхнему, т. е. самовоспламенение, осуществляется при уменьшении расхода газа до значения G < G1. Если теперь увеличивать расход газа, то высокотемпературный режим будет существовать и при значениях G, больших чем G1, вплоть до G = G2, при котором произойдет переход к низкотемпературному режиму («потухание»).
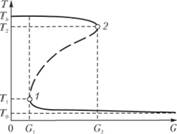
Рис. 3.20. Зависимость температуры газа в гомогенном химическом реакторе от массового расхода газа (без учета теплопотерь). Пунктиром показана неустойчивая часть кривой.
Пунктирная часть кривой на рис. 3.20 соответствует неустойчивым режимам, которым отвечают точки типа точки G на рис. 3.19, и поэтому без специального регулирующего устройства неосуществима. Найдем значения расхода газа и температуры, соответствующие воспламенению (точка 1) и потуханию (точка 2), полагая для простоты п = 1:
Дифференцируя данное уравнение по Т и удовлетворяя условию dG/dT = 0, получим квадратное уравнение относительно Г, из которого с точностью до малых второго порядка по параметрам RT0/E, RTb/E следует Итак, разогрев газа на величину, превышающую характеристический интервал, приводит, как и в теории теплового взрыва, к самовоспламенению. В режиме горения понижение температуры газа на такую же величину, но уже построенную по максимальной температуре Tb, приводит к потуханию; это явление не имеет аналогии в теории теплового взрыва.
Заметим, что температура Т2 с точностью до малых второго порядка по параметру RTb/E совпадает с температурой T•, в которой достигается максимум тепловыделения (ср. значения Т2 из (3.108) и Т* из (3.65)).
Подстановка значений T1 и Т2 в (3.108) дает значения массового расхода газа:
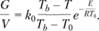 (3.107).
(3.107).
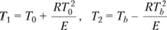 (3.108).
(3.108).
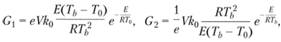 (3.109).
(3.109).
которые определяют границы существования каждого из режимов.
Экспериментально высокотемпературный стационарный режим горения впервые был осуществлен Дж. П. Лонгвеллом и ?. ?. Вейссом в сферическом реакторе идеального смешения, схема которого представлена на рис. 3.21. Гомогенная смесь окислителя (воздух) и горючего (смесь углеводородов) предварительно хорошо перемешивалась, подогревалась до нужной температуры (чтобы испарились капли горючего) и подавалась через множество щелей (1), проделанных в небольшом металлическом шарике (2), располагавшемся в центре реактора. Продукты реакции выводились через каналы (3) во внешней оболочке реактора (4). Полученные данные по пределам существования высокотемпературного режима и анализ состава продуктов реакции позволили установить кинетические параметры реакции и высказать соображения о лимитирующей стадии химического превращения, ею оказалась стадия окисления оксида углерода. Зависимости Т(G) в гомогенном химическом реакторе были получены экспериментально.
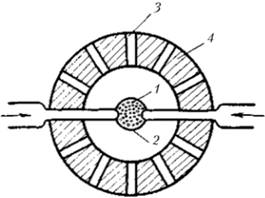
Рис. 3.21. Схема гомогенного химического реактора, использованного Дж. П. Лонгвеллом и М. А. Вейссом (1955) для изучения процесса горения углеводородов.