Конформация.
Биология

Поскольку данные белковые комплексы, как правило, характеризуются лабильностью (т.е. в процессе их функционирования имеют место переходы полимерной формы в протомерную и обратно), они стабилизированы слабыми силами — ионными, водородными и гидрофобными. Однако в некоторых случаях, когда функционирование белка не предполагает его обратимую диссоциацию на субъединицы, последние достаточно прочно… Читать ещё >
Конформация. Биология (реферат, курсовая, диплом, контрольная)
Первичная структура необходима и достаточна для формирования определенной геометрической формы белковой молекулы — конформации (от лат. conformatio — форма, построение, расположение).
Рассмотрим далее виды конформации.
1. Вторичная структура — совокупность участков полипептидной молекулы, имеющих регулярную структуру.
Типы вторичной структуры следующие.
• Альфа-спираль (рис. 3.47, а): правильная правозакрученная спираль, возникающая в результате образования водородных связей между карбонильными и иминогруппами аминокислотных звеньев (между каждым 1-м и 5-м); пример — глобин.
Примечание. Геометрическая правильность альфа-спирали объясняется тем обстоятельством, что в ее построении принимает непосредственное участие только та часть молекулы аминокислоты, которая одинакова у всех биологически значимых аминокислот. При этом радикалы аминокислотных остатков ориентированы от поверхности спирали и таким образом не искажают ее пространственную регулярность. Некоторые количественные параметры альфа-спирали: на один виток спирали приходится 3,6 аминокислотных остатков, шаг спирали составляет 0,54 нм, диаметр — 0,5 нм.

Рис. 3.47. Вторичная структура белка:
а — альфа-спираль; б — складчатая структура (бета-структура).
• Складчатые слои (бета-структура) (рис. 3.47, б), бета-листы: периодическая складчатая конфигурация, возникающая в результате образования водородных связей между параллельно ориентированными участками полипептидной молекулы или нескольких молекул; примеры — бета-кератины (входят в состав когтей и панциря рептилий, клюва и перьев птиц), фиброин шелка, белок паутины. Примечательно, что компактная упаковка таких молекул в конкретных биологических структурах, в частности, нитях шелка, достигается благодаря тому, что гидрофильные радикалы аминокислотных остатков располагаются по одну сторону «листа», гидрофобные — по другую.
Примечание. Формирование в некоторых белках устойчивых (энергетически предпочитаемых) ансамблей альфа-спиралей и бета-структур (так называемых структурных мотивов) послужило основанием для выделения в качестве самостоятельного уровня пространственной организации белковой молекулы сверхвторичной структуры. Структурные мотивы часто встречаются в белках, связанных с ДНК.
- • Трехчленная спираль: особая спиралевидная структура, возникающая в результате переплетения трех полипептидных цепей (коллаген). Стабилизирваны водородными связями.
- 2. Третичная структура — пространственная организация белковой молекулы.
Типы третичной структуры:
- • глобулярная, близкая к сферической (глобин) (рис. 3.48, а);
- • фибриллярная, или нитчатая (альфа-кератин — основной белок волос, шерсти, рогов, когтей и копыт млекопитающих; миозин, точнее, стержневая часть его молекулы) (рис. 3.48, б).
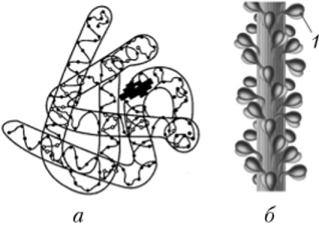
Рис. 3.48. Третичная структура белка:
а — глобулярная (глобин); б — фибриллярная (миозин; 1 — «головки» для взаимодействия с актином) Стабилизирующими силами являются дисульфидные связи (ковалентные связи типа —S—S—, соединяющие остатки серосодержащих аминокислот), ионные связи, водородные связи, гидрофобные взаимодействия (образование во внутреннем объеме белковой молекулы гидрофобных ядер — областей, где сконцентрированы неполярные радикалы аминокислотных остатков и отсутствует вода, — рис. 3.49).
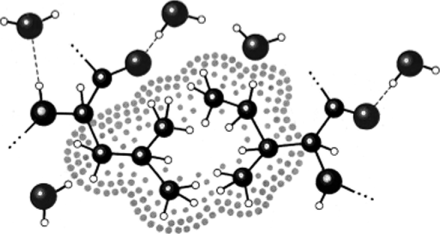
Рис. 3.49. Гидрофобное ядро в молекуле белка.
Примечание. Необходимо отметить, что обнажение внутренних гидрофобных областей белковых молекул может иметь для клетки весьма серьезные последствия. Дело в том, что взаимодействие таких молекул (вероятность которого достаточно велика, если принять во внимание, что цитоплазма представляет собой концентрированный белковый раствор) приводит к образованию нерастворимых агрегатов. При этом данный процесс имеет тенденцию к генерализации. Примером может служить боковой амиотрофический склероз — наследственное заболевание, вызванное мутацией гена, кодирующего один из ключевых антиоксидантных ферментов — Си, Znсупероксиддисмутазу. Дефектный белок, по всей вероятности, за счет меиее прочных связей с ионами металлов проявляет повышенную склонность к агрегации. Причем данный процесс характеризуется строгой избирательностью: он реализуется только в мотонейронах спинного мозга и ствола головного мозга. Те нейроны, в которых количество агрегированного фермента превышает некое критическое значение, гибнут. Клинически это проявляется в параличе конечностей и атрофии мышц. В последней стадии заболевания пациенты умирают от отказа дыхательной мускулатуры.
Процесс укладки белковой молекулы в пространстве протекает в несколько этапов. Сначала возникает «ядро сворачивания» (своего рода аналог зародыша кристаллизации), после чего пространственная структура молекулы образуется достаточно быстро, почти без перебора вариантов. О закономерном ходе данного процесса также свидетельствует факт ограниченности числа типичных молекулярных архитектур (глобулярная, фибриллярная и некоторые другие). Считается, что основным фактором их отбора является физическая стабильность.
В структуре молекулы ряда крупных белков со сложной структурой имеются относительно автономные части (домены), различающиеся по строению и частным функциям. В эволюции эти молекулы сформировались таким образом, что изменение структуры одного домена индуцирует коиформационные преобразования другого домена (доменов), благодаря чему достигаются координация их функций и более тонкая регулировка работы молекулы в целом. Так, молекула мембранного белка-рецептора, как правило, состоит из трех доменов: надмембранного (выполняет функцию молекулярной «антенны»), внутримембранного (играет роль «якоря») и подмембранного (осуществляет передачу сигнала вглубь клетки) (рис. 3.50). В качестве другого примера можно привести альбумин сыворотки крови. Его молекула содержит три домена, имеющие центры связывания для различных метаболитов (билирубина, жирных кислот), лекарственных веществ и токсинов. Основной функцией данного белка является избирательное связывание одного или нескольких субстратов и доставка их в определенные органы (ткани). От функционального состояния сывороточного альбумина (полноценности центров связывания, степени нагруженности их тем или иным субстратом и др.) зависит, насколько успешным будут применение лекарственных средств, а также развитие и исход отравлений.
Процесс формирования пространственной структуры белковой молекулы называется фолдингом. Данный процесс является энергоемким, протекает в несколько стадий, катализируется специальными ферментами и осуществляется в присутствии особых вспомогательных белков — шаперонов. Эти белки присоединяют к себе вновь образованную на рибосоме полипептидную цепочку и создают условия для укладки ее геометрической структуры.
Примечание. Нарушение формирования пространственной структуры белковых молекул может приводить к возникновению аномальных форм белков (в частности, прионов и амилоидов) и впоследствии — развитию ряда тяжелых заболеваний. Так, установлено, что искажение конформации одной из групп мембранных белков, играющих важную роль в обеспечении нервных клеток ионами меди (в результате чего они превращаются в прионы), лежит в основе ряда заболеваний человека и животных, соиря;

Рис. 3.50. Доменная структура белка (на примере мембранного белка-рецептора):
1 — надмембранный домен (молекулярная антенна); 2 — внутримембранный домен (гидрофобный якорь); 3 — подмембранный домен женных с выраженными дегенеративными изменениями в нервной системе (болезнь Альцгеймера, болезнь Паркинсона, губчатая энцефалопатия крупного рогатого скота).
Необходимо специально отметить, что молекулы некоторых функционально активных белков не имеют строго упорядоченной структуры (или содержат достаточно протяженные неупорядоченные участки). В качестве примеров можно привести белок центральной гранулы ядерной поры, выполняющий функцию молекулярного сита, и белок-ингибитор клеточного деления, способный «обвивать» молекулу фермента-регулятора митоза и экранировать область, где располагается сто активный центр.
3. Четвертичная структура возникает при объединении нескольких полипептидных молекул (субъединиц, протомеров) в комплекс (рис. 3.51). Из рассмотрения рисунка можно сделать вывод, что белок состоит из четырех субъединиц — двух альфаи двух бета-субъединиц, с каждой из которых связана группа гема, содержащая ион двухвалентного железа; переносимый гемоглобином кислород присоединяется к гему.

Рис. 3.51. Четвертичная структура белка (на примере гемоглобина)
В состав комплекса может входить две, четыре и более одинаковых или различных субъединиц.
Поскольку данные белковые комплексы, как правило, характеризуются лабильностью (т.е. в процессе их функционирования имеют место переходы полимерной формы в протомерную и обратно), они стабилизированы слабыми силами — ионными, водородными и гидрофобными. Однако в некоторых случаях, когда функционирование белка не предполагает его обратимую диссоциацию на субъединицы, последние достаточно прочно связываются между собой с помощью специальных пептидов. Благодаря последним не только обеспечивается устойчивость белкового агрегата, но и поддерживается необходимое количественное соотношение в нем различных протомеров. Примером может служить гемоглобин, состоящий из двух альфаи двух бета-субъединиц.
На уровне четвертичной структуры реализуется (ив этом состоит ее физиологический смысл) так называемый кооперативный эффект, сущность которого заключается в том, что благодаря взаимным влияниям субъединиц функциональная «мощность» белкового комплекса резко возрастает и многократно превышает сумму функциональных потенций составляющих его протомеров.
Можно привести следующие примеры:
- • гемоглобин состоит из четырех субъединиц; присоединение кислорода к одной субъединице резко ускоряет присоединение сто к последующим (до 300 раз);
- • фермент, расщепляющий перекись водорода (каталаза), состоит из четырех субъединиц; фермент может находиться как в протомериой форме, так и в тетрамерной; каталитическая активность фермента в форме тетрамера в 1 000 000 раз превышает сто активность в «разобранном» виде.