Основные понятия и определения

Система — тело или несколько тел, находящихся во взаимодействии (диффузия, теплообмен, химическая реакция) и отделенных от окружающей среды (рис. 1.2). Системы имеют определенные границы, отделяющие их от внешней среды, и могут быть гомогенными или гетерогенными. Гомогенная система — система, в которой все макроскопические свойства в любых ее частях имеют одно и то же значение или непрерывно… Читать ещё >
Основные понятия и определения (реферат, курсовая, диплом, контрольная)
Химическая термодинамика — наука, изучающая условия устойчивости систем и законы, их определющие. Термодинамика — наука о макросистемах. Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические явления в ней исследуются с помощью основных законов термодинамики. Состояние рассматриваемых объектов определяется непосредственно измеряемыми величинами, характеризующими вещества; механизм процесса и сама структура вещества не рассматриваются. В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям (рис. 1.1).
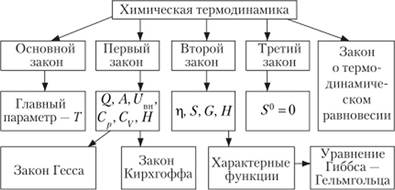
Рис. 1.1. Основные законы и параметры химической термодинамики.
Рассматривают главным образом:
- 1) тепловые балансы процессов, включая тепловые эффекты физических и химических процессов;
- 2) фазовые равновесия для индивидуальных веществ и смесей;
- 3) химическое равновесие.
Тепловые балансы составляют на основе первого закона термодинамики. На основе второго и третьего законов проводят анализ фазового и химического равновесий.
Изучение законов, которые описывают химические и физические равновесия, имеет огромное значение в химической термодинамике. Значение их позволяет решать задачи для производственной и научно-исследовательской работы.
Рассмотрим основные задачи:
- 1) определение условий, при которых данный процесс становится возможным;
- 2) нахождение пределов устойчивости изучаемых веществ в тех или иных условиях;
- 3) устранение побочных реакций;
- 4) выбор оптимального режима процесса (давления, концентрации реагентов и т. д.).
При изложении основных положений термодинамики пользуются определенными понятиями.
Система — тело или несколько тел, находящихся во взаимодействии (диффузия, теплообмен, химическая реакция) и отделенных от окружающей среды (рис. 1.2). Системы имеют определенные границы, отделяющие их от внешней среды, и могут быть гомогенными или гетерогенными. Гомогенная система — система, в которой все макроскопические свойства в любых ее частях имеют одно и то же значение или непрерывно меняются от точки к точке. Примеры: ненасыщенные растворы, пар, газовые смеси. Составные части гомогенной системы не могут быть выделены из нее с помощью простых механических приемов (фильтрования, отбора и т. д.). Гетерогенная система — система, составные части которой отделены друг от друга видимыми поверхностями раздела, па которых происходят резкие скачкообразные изменения какого-либо свойства. Примеры: насыщенный раствор какой-либо соли, находящийся в равновесии с кристаллами этой соли, две несмешивающиеся жидкости и т. д. Составные части такой системы могут быть отделены друг от друга с помощью механических операций.
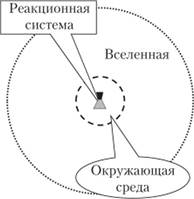
Рис. 1.2. Схематическое положение системы.
Состояние системы в термодинамике определяется с помощью набора переменных, называемых параметрами состояния и характеризующих термодинамическое состояние при равновесии. Всякое изменение, происходящее в системе и связанное с изменением хотя бы одного из параметров состояния, называется термодинамическим процессом.
Под понятием тело в химической термодинамике подразумевается какое-либо вещество (например, вода, воздух, железо, соль, раствор вещества), которое характеризуется определенными свойствами (плотность, температура, давление, концентрация и др.) и занимает определенный объем, при этом его внешний вид (цвет, форма) представляется несущественным.
Всякий материальный объект, состоящий из большого числа частиц (молекул, атомов, ионов), условно отделяемый от окружающей среды, является термодинамической системой. Это может быть кристалл минерала, раствор любого вещества в какой-либо емкости, газ в баллоне, отдельная клетка организма или организм в целом. При взаимодействии системы с окружающей средой она может получать или отдавать энергию в виде тепла или работы. Так, горячий кусок металла, охлаждаясь, отдает энергию окружающему воздуху. Газ, заключенный в цилиндр, закрытый поршнем, при расширении совершает работу. Кроме того, система может обмениваться со средой веществом в результате, например, диффузии вещества из системы в окружающую среду и наоборот. В соответствии с различными видами взаимодействия с окружающей средой все термодинамические системы можно классифицировать следующим образом.
1. Если система не обменивается со средой ни энергией, ни веществом, то эта система называется изолированной.
В природе не существует изолированных систем. Любая реальная система взаимодействует с окружающей средой. И поэтому понятие изолированная система — э го воображаемое теоретическое построение. Представим себе, например, реагирующую смесь из водорода и кислорода в запаянном сосуде со стенками из теплоизоляционного материала. Такая система не обменивается с окружающей средой энергией и веществом, хотя мы понимаем, что идеальной теплоизоляции пет, и эту систему можно считать изолированной на небольших промежутках времени, когда незначительным, но все же имеющим место теплообменом можно пренебречь.
Экспериментальное исследование изолированной системы невозможно, так как для получения информации о ее состоянии нужно вводить в нее сигналы и получать их обратно, что противоречит определению понятия изолированная система. Но мы будем пользоваться этим понятием, помня о его идеализированном характере.
- 2. Система называется закрытой (замкнутой), если между пей и окружающей средой возможен обмен энергией в виде теплоты и (или) работы, но невозможен обмен веществом. Пример — закрытый сосуд с веществом. Искусственные замкнутые экосистемы — еще один интересный пример. В этих рукотворных системах имитируются условия существования организмов в космических кораблях, используется только внешняя энергия, а все необходимые для организмов (включая человека) вещества производятся внутри системы, при этом осуществляется и утилизация отходов в результате замкнутых циклов. Работы с замкнутыми экосистемами в настоящее время активно ведутся в Кэннеди Спейс Центре (США). В 1970;х гг. ведущими специалистами в этом направлении считались ученые Института биофизики СО РАН (г. Красноярск).
- 3. Открытой является система, которая обменивается с окружающей средой и веществом, и энергией. Примеры: живые организмы по отношению к окружающей среде, клетка по отношению ко всему организму в целом.
На рис. 1.3 представлены все три типа систем.
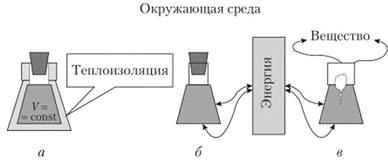
Рис. 1.3. Схематическое изображение трех типов систем (в виде реакционной колбы):
а — изолированная; б — замкнутая; в — открытая.
Теплота и работа. Прежде чем перейти к рассмотрению изменения внутренней энергии U в зависимости от параметров состояния системы, разъясним понятия теплота и работа. Энергия, теплота и работа измеряются в одних и тех же единицах — джоулях (Дж). На основании этого можно ли считать, что эти понятия равнозначны?
Когда мы говорим об энергии, то представляем себе запас возможной, но еще неосуществленной работы. Можно ли сказать, что теплота и работа есть «запас теплоты» или «запас работы»? Когда проявляется теплота, то имеется, по меньшей мере, два тела: одно, которое отдает энергию (с более высокой температурой), и другое (с меньшей температурой), которое получает ее за счет разности температур. Точно так же, когда выполняется работа, то имеется тоже, по меньшей мере, два тела: одно, которое развивает силы, совершающие работу, и другое, к которому эти силы приложены. Первое тело, производящее работу, отдает энергию, второе тело получает ее. То есть понятия «теплота» и «работа» связаны с процессом передачи энергии, и не относятся к состоянию системы. Теплота и работа представляют два возможных способа передачи энергии от одного тела к другому, от одной системы к другой.
Теплота представляет собой совокупность микрофизических актов процесса передачи энергии (обмен энергией при соударении молекул, атомов, излучения квантов света и т. д.), т. е. неупорядоченного способа обмена энергии между системами вследствие хаотичности перемещения частиц, что более вероятно, чем направленное движение всех частиц.
Возникновение теплоты в процессе всегда свидетельствует о малоэффективном способе передачи энергии, так как вероятность того, что хаотическое движение получит определенную направленность для совершения работы маловероятно. Поэтому полный переход энергии посредством теплоты в работу невозможен, хотя работа может перейти в теплоту целиком.
Работа — это любая макрофизическая, упорядоченная, направленная форма передачи энергии за счет передвижения масс под действием какихлибо направленных сил.
Обмен энергией между системой и внешней средой обусловливается работой (А), совершаемой этой системой:
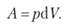 (1.1).
(1.1).
Работа определяется суммой произведений сил, действующих на систему (давления и изменения объема). Работа не является полным дифференциалом ДА.
Если протекают равновесные процессы, то работа равновесного процесса будет максимальной величиной по сравнению с неравновесным процессом: 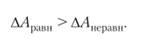
Если тело надо нагреть, это значит, что телу сообщают определенное количество теплоты, а охладить систему — произвести действие, обратное нагреванию, т. е. отвести энергию.
Работа может быть использована на пополнение запасов различных видов энергии: электрической, магнитной, кинетической и др. Теплота же, как способ передачи энергии, без преобразования ее в работу, может пополнять только запас внутренней энергии системы. Количество поглощенной (выделенной) теплоты в процессе, как и совершенной работы, зависит от способа проведения процесса (например, проводится ли процесс при постоянном объеме или постоянном давлении). Следовательно, и теплота, и работа не являются функциями состояния (в противоположность энергии). В системе энергия может быть сообщена двумя единственно возможными способами: в виде работы А и тепла Q. Работа и теплота являются количественными характеристиками двух форм обмена энергией между системой и окружающей средой.
Понятие внутренней энергии. Внутренняя энергия системы Um складывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия.
Внутренняя энергия является функцией состояния. Функция состояния обладает двумя особенностями:
- — при переходе системы из одного состояния в другое изменение параметра не зависит от пути перехода;
- — если система совершает круговой процесс, возвращаясь в исходное состояние, то изменение параметра системы равно нулю.
На рис. 1.4, а схематично представлено изменение внутренней энергии системы в процессе перехода ее из состояния 1 в состояние 2 по пути а или б. Независимо от пути перехода изменение внутренней энергии, равное AU = U2 — U1 оказывается одним и тем же, поскольку оно определяется лишь начальным и конечным состояниями системы.
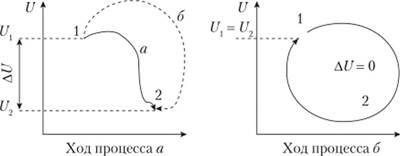
Рис. 1.4. Изменение внутренней энергии системы:
а — при переходе из состояния 1 в состояние 2 по пути а или б; б — при переходе через различные состояния в исходное состояние 1.
В случае же совершения какого-то процесса и возвращения системы в исходное состояние (рис. 1.4, б) изменение внутренней энергии оказывается равным нулю: AU = 0. В этом случае мы даже не можем сказать, а был ли процесс, если будем судить только по начальным и конечным параметрам состояния, не принимая во внимание фактор времени.
Внутренняя энергия U определяется параметрами состояния системы: температурой Г, давлением Р, объемом V:
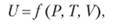
которые в свою очередь связаны с кинетической и потенциальной энергией частиц системы.
Энергия системы складывается из энергии ее составных частей, т. е. она обладает свойством аддитивности:
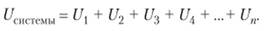
Так как запас внутренней энергии U зависит и от количества вещества, то для определенности и простоты при расчетах в химической термодинамике условились относить его к 1 моль вещества.
Единицей измерения внутренней энергии служит джоуль (Дж) или в старых литературных изданиях — калория (кал), которые связаны между собой простым соотношением: 1 кал = 4,184 Дж.
Вычислить или экспериментально определить абсолютное значение внутренней энергии системы в начальном Ux и в конечном состоянии U2 мы не можем (ведь нам даже не известны все виды энергии). При изменении состояния системы, т. е. при переходе ее из начального состояния с запасом внутренней энергии (/, в конечное с запасом внутренней энергии U2, которое сопровождается энергетическими эффектами, мы можем найти изменение запаса внутренней энергии ДU системы (рис. 1.5):
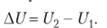 (1.2).
(1.2).
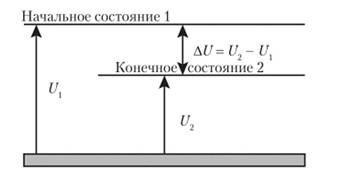
Рис. 1.5. Изменение внутренней энергии системы при переходе из одного состояния в другое.
На первый взгляд это парадокс: не зная величин U2 и U1. можно найти их разницу (U2 — U1). Говоря о переходах системы в различные состояния, представим себе, что переход изолированной системы из состояния 1 в состояние 2 связан с изменением внутренней энергии Д?/|, а при обратном переходе (из состояния 2 в состояние 1) в исходное состояние — с изменением внутренней энергии ДU2. Если Д и ДU2 не равны Д U1,? ДU2, то мы получаем при этих переходах или выигрыш, или потерю внутренней энергии системой, которая вследствие изолированности системы ничем не компенсируется. Однако это невозможно, так как в противном случае нарушается закон сохранения энергии: энергия возникает из ничего или теряется неизвестно куда. Поэтому одной из формулировок первого закона термодинамики является утверждение: в изолированной системе сумма всех видов энергии постоянна.
Внутренняя энергия системы зависит от ее состояния, определяемого параметрами Т, Р, V, и, соответственно, ДU — изменение внутренней энергии — также будет зависеть от этих параметров.
Для многих практических целей важно знать энергетические изменения в системах при постоянном объеме и постоянном давлении, так как большинство химических процессов протекает при постоянном давлении (чаще всего — атмосферном), и при постоянном объеме (объеме раствора, сосуда).
Следовательно, Umt является полным дифференциалом, она не зависит от пути процесса, а зависит от начального и конечного состояний системы, она однозначно непрерывна и конечна. Абсолютное значение URil определить нельзя, можно определить только ее изменения.
Изменение внутренней энергии должно складываться из двух этих величин: количества энергии, переданной в виде тепла Q, и энергии, переданной посредством работы, — А.
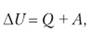 (1.3).
(1.3).
Но эти вклады при переходе обезличиваются, превращаясь в единую величину — энергию U. Не существует величины, которую можно было бы назвать теплотой тела Q, как нет и внутри тела величины, которую можно назвать работой А.
Следовательно, нельзя говорить о теплоте как об отдельной (независимой) «форме энергии», «запасе теплоты», «приращении теплоты» системы (тела) и тому подобное, что мы порой делаем. Это историческое наследие от вещественной теории теплоты (теплороде), развитой во второй половине XVIII в. Этой теории мы также обязаны введением понятий «теплотворная способность», «теплоемкость», «скрытая теплота» и некоторых других.
В дальнейшем, употребляя термины «теплота», «тепловой эффект реакции», мы будем однозначно представлять себе передачу какой-то определенной части энергии за счет разности температур между телами. А количество энергии, переданной системой (системе) в процессе работы, будем называть количеством работы, или работой.
Таким образом, принятая для теплоты и работы размерность энергии, не доказывает тождества их с энергией. Q и А качественно и количественно характеризуют форму передачи энергии, взаимосвязь между Q, А, (7ВН устанавливает первый закон термодинамики.
Параметры состояния. Состояние системы характеризуется параметрами состояния, к которым относят: объем, давление, температуру, количество вещества, концентрацию, энергию и ряд других.
Термодинамическим параметром может быть любое свойство системы, если оно рассматривается как одно из независимых переменных, определяющих состояние системы.
Если все параметры состояния не изменяются во времени, то говорят, что система находится в равновесном состоянии, или просто — в равновесии. В химической термодинамике свойства системы рассматриваются в ее равновесных состояниях: начальном (исходном) и конечном.
Предположим, например, что некая система из начального равновесного состояния 1 с параметрами Т1, Р1, V1 переходит в новое (конечное) состояние 2, характеризующееся параметрами Т2, Р2, V2. Естественно, что в процессе перехода параметры состояния системы непрерывно изменяются. Химическая термодинамика изучает не промежуточные значения параметров состояния системы, а их значения в начальном и конечном равновесных состояниях. На основании этого делается вывод о возможности протекания процессов в указанном направлении и энергетических изменениях, сопровождающих эти процессы. Применительно к рассматриваемой нами системе о ее свойствах приходится судить по изменению параметров: АТ = Т2 — Т1; АР = Р2 — Р1 и AV = V2 — V1в результате перехода системы из состояния 1 в состояние 2.
Следует отметить, что в термодинамике принято из параметров конечного состояния вычитать параметры начального состояния. Термодинамические параметры состояния системы характеризуют лишь данное состояние, никак не свидетельствуя о предшествующих или промежуточных состояниях системы. Другими словами, при переходе системы из одного состояния в другое изменение ее свойств не зависит от пути перехода (процесса), а определяется лишь начальным и конечным состоянием системы. Можно сказать, что система не «помнит» своей истории.
Можно представить себе процесс, в котором система, выйдя из некоторого начального состояния и претерпев ряд изменений, вновь возвращается в него. Следовательно, она вновь приобретает те же свойства, которые имела в исходном состоянии. Мы же не имеем никакой информации о природе процесса (и был ли он?), но можем характеризовать систему, рассматривая ее начальное и конечное состояния.
Таким образом, если в термодинамической системе определенное свойство не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы являются равновесными. В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды.
Обратимые процессы — процессы, в которых система возвращается в первоначальное состояние.
Необратимые процессы — процессы, в которых система не возвращается в первоначальное состояние.
Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, — функции состояния; внутренняя энергия, энтальпия, энтропия и др. — полные дифференциалы. Функции, которые зависят от начального и конечного состояний системы и от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q А.
Функции можно разделить на две группы: экстенсивные и интенсивные.
Экстенсивное свойство системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать): V, II, (7В", S, G, F.
Интенсивное свойство системы не зависит от массы системы и не обладает свойством аддитивности: Q, А, Т, р.
Давление — параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой.
Температура определяет меру интенсивности теплового движения молекул. Значение градуса температуры и начало ее отсчета произвольны. В качестве эталона можно было бы выбрать не воду, а любое другое вещество (лишь бы его свойства однозначно изменялись с температурой, были воспроизводимы и легко поддавались измерению). Такая произвольность исчезает, если пользоваться термодинамической (абсолютной) шкалой температур, основанной на втором законе термодинамики. Начальной точкой этой универсальной шкалы является значение предельно низкой температуры — абсолютный нуль, равный — 273,15°С.
При изменении параметров системы изменяется также ее состояние, т. е. в системе осуществляется термодинамический процесс. Процесс, протекающий при постоянной температуре, называется изотермическим, при постоянном давлении — изобарным, при постоянном объеме — изохорным.
Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, — уравнение состояния.
Вследствие взаимосвязи между свойствами системы для определения ее состояния достаточно указать лишь некоторое число свойств. Так, состояние газа можно считать заданным, если указаны два параметра, например температура и объем, а значение третьего параметра — давления — можно определить из уравнения состояния:

Графически это уравнение является уравнением поверхности, построенной на трех взаимно перпендикулярных осях, каждая из которых соответствует одному термодинамическому параметру.
Таким образом, термодинамическая поверхность — геометрическое место точек, изображающих равновесные состояния системы в функциях от термодинамических параметров.
Термодинамические показатели. Баланс напряжений. К термодинамическим показателям относятся те, которые можно рассчитать, используя законы термодинамики, исходя из условия, что система находится в равновесии.
Напряжение разложения (Uр):
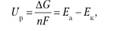
где AG — изменение термодинамического потенциала; п — число электронов, участвующих в химической реакции; F — число Фарадея, F= 96,500 К/моль (26,8 А • ч/моль); а — анод; к — катод; р — разложение;
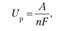
где A — максимальная работа, которую способна совершить система в равновесном состоянии;
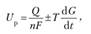
где Q — тепловой эффект реакций; Uр — термодинамическая характеристика электрохимической системы, которая мало зависит от условий электролиза.
Отклонение системы — поляризация. Электрохимическая реакция является гетерогенным процессом, и ее скорость может лимитироваться одной из стадий:
- 1) подвод реагирующего вещества к границе раздела фаз;
- 2) разряд и ионизация;
- 3) отвод продуктов реакции.
Поляризация, определяемая медленной стадией массопереноса, — концентрационная. Если медленной стадией является стадия разряда ионизации, то поляризация называется перенапряжением. Природа и значение поляризации зависят от многих факторов: природы реагирующего вещества, материала электрода, состояния поверхности электрода, плотности тока, состава раствора и режима электролиза. Кинетический параметр — параметр, определяемый в реальных условиях электрохимической системы: плотность тока (р), энергия активации (?актив), коэффициент диффузии, коэффициент переноса, а (на катод), р (на анод) — доля расхода на процесс.
Сила тока в электрохимическом аппарате I = iкSед загрузки, ік — плотность катодного тока, в зависимости от электролита; SСД — единичная площадь.
Химический эквивалент элемента A равен отношению части массы элемента, которая присоединяет или замещает в химических соединениях одну атомную массу водорода или половину атомной массы кислорода, к 1/12 массы атома 12С. Понятие «химический эквивалент» применимо и к соединениям. Так, химический эквивалент кислоты численно равен ее молярной массе, деленной на основность (число ионов водорода); химический эквивалент основания — его молярной массе, деленной на кислотность (у неорганического основания — на число гидроксильных групп); химический эквивалент соли — ее молярной массе, деленной на сумму зарядов катионов или анионов.
Скорость электролиза — образование массы вещества за единицу времени:
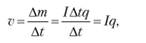
где q — электрохимический эквивалент.
Баланс напряжений. Напряжение на электрохимическом аппарате определяет расход электроэнергии при электролизе. Баланс напряжений на электрохимическом аппарате складывается из следующих составляющих:
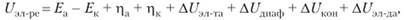
где Е.a — обратимый потенциал анода, В; Eк — обратимый потенциал катода, В; ца— поляризация анода, В; цк — поляризация катода, В;— падение напряжения в электролите, В; ДUдиаф — падение напряжения в диафрагме, В; AUKOU — падение напряжения в контактах. В; ДUэл_да — падение напряжения в электродах, В.
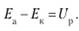
Величина Eа — Ек, как сказано выше, называется напряжением разложения. Эта величина соответствует расходу на электролиз электроэнергии, которая идет непосредственно на изменение внутренней энергии веществ. При электролизе стремятся к уменьшению напряжения на ячейке за счет величины поляризации и омического состояния баланса напряжения, т. е. слагаемых, обусловленных необратимостью процесса. Напряжение разложения обусловлено природой реагирующего вещества, а поэтому не может быть изменено. Значения ДЕ.a и ДEк могут быть изменены в зависимости от характера электрохимической реакции, протекающей на электроде, путем перемешивания, повышения температуры электролита, изменения состояния поверхности электрода и за счет ряда других факторов.
Падение напряжения в электролите выражается уравнением.
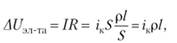 (1.4).
(1.4).
где р — удельное сопротивление электролита; / — расстояние между электродами (без учета диафрагмы); S — площадь поперечного сечения электролита, через которую проходит электрический ток.
Может быть уменьшено, как следует из приведенного выражения, сближением электродов, введением в раствор более электроотрицательных добавок, а также повышением температуры. Если электролиз сопровождается образованием газов, то приведенное выше выражение не всегда точно соответствует падению напряжения в электролите. Это объясняется тем, что выделяющиеся на электродах пузырьки газов уменьшают активное сечение электролита S и удлиняют путь тока от одного электрода к другому. Это явление называется газонаполнением, которое может быть определено как отношение объема занимаемого в данный момент пузырьком воздуха к общему объему электролитической ячейки.
Введем коэффициент газонаполнения:
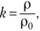
где р и р0 — соответственно удельные сопротивления сплошного и газонаполненного электролита, тогда выражение (1.4) можно записать.
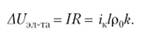 (1.5).
(1.5).
Влияние газонаполнения на электропроводность электролита может быть учтено с помощью следующего выражения:
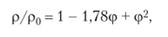
где р и р0 — соответственно удельные сопротивления сплошного и газонаполненного электролита; ф — газонаполнение.
Величина ф может быть уменьшена повышением температуры, а также особым устройством электродов, обеспечивающих свободное удаление газов из ячейки.
Падение напряжения в диафрагме:
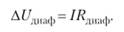
Что касается падения напряжения в контактах, то эта величина зависит от совершенства контактов, чистоты контактирующих поверхностей. Существует довольно много конструктивных решений электродных контактов.
Падение напряжения в контактах обычно принимают равным 5 -10% от общего напряжения.
Паление напряжения в электродах:

Снижение напряжения на электрохимическом аппарате характеризуется оптимальным расстоянием между электродами.
К энергетическим характеристикам относятся:
- 1) напряжение на электрохимическом аппарате;
- 2) отдача по напряжению
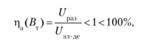
где Вт — выход по току;
3) отдача по емкости.
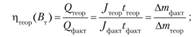
4) отдача по энергии.
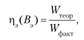
где Вэ — выход, но энергии;
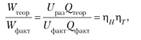
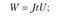
5) производительность электрохимического аппарата оценивается количеством продукта па единицу затраченной энергии.
Расход электрической энергии на 1 т произведенного продукта определяется так: 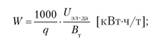
где Вт — выход по току в долях единицы 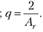
Энергетический баланс — устанавливает соотношение между видом энергии, поступающей в электролизер, и энергией, уходящей из него, демонстрируя равенство статей прихода и расхода. Энергия постоянного тока, подводимая к электролизеру, составляет:
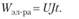
Общее уравнение энергетического баланса имеет следующий вид:
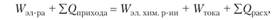
где ЕQприхода — тепловая энергия, поступающая в электролизер с электролитом и электродами за счет вторичных процессов; W3JI хнм р.ин — энергия тока, затраченная на электрохимическую реакцию; WT0Ka — энергия тока, перешедшая в тепловую энергию; EQpacx — тепловая энергия, уносимая электролитом, электродами, газами при испарении Н20, излучении и конвекции.
Идеальные газы. Уравнение состояния идеальных газов
Уравнением состояния идеального газа является уравнение Клапейрона — Менделеева; простейшим уравнением состояния реального газа — уравнение Ван-дер-Ваальса.
Здесь следует напомнить отличия реального газа от идеального. В идеальном газе отсутствует взаимодействие между молекулами, а сами молекулы принимаются за материальные точки с нулевым объемом. Реальные газы подчиняются законам идеальных газов при низких давлениях и высоких температурах. Именно при этих условиях взаимодействием между молекулами и их объемом можно пренебречь.
Уравнение Клапейрона — Менделеева имеет следующий вид:
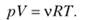 (1.6).
(1.6).
Здесь р — давление; V — объем; v — количество молей идеального газа; Т — абсолютная температура; R — коэффициент пропорциональности, который называется универсальной газовой постоянной. В системе СИ R = 8,31−103 Дж/кмольК. В химии обычно используется величина R, равная 8,31 Дж/моль — К.
Уравнение Клапейрона — Менделеева является универсальным, так как оно применимо ко всем газам, которые ведут себя как идеальные, независимо от их природы — N2, 02, Не и т. д.
Для описания поведения реальных газов используется уравнение Вандер-Ваальса;
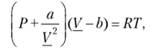
где V — объем 1 моля газа.
Это уравнение учитывает отклонение свойств реальных газов от свойств идеальных в результате взаимного притяжения молекул газа и наличия у них собственного объема. Эти отклонения описываются поправками к давлению газа 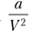 и его объему — b. Легко видеть, что при больших V
и его объему — b. Легко видеть, что при больших V
эго уравнение переходит в уравнение состояния идеальных газов.
Введение
дополнительных слагаемых объясняется следующим образом. Силы взаимного притяжения молекул реального газа уменьшают давление на стенки сосуда по сравнению с давлением, которое оказывал бы идеальный газ. Эти силы обратно пропорциональны г6 (г — расстояние между взаимодействующими молекулами) или V2. Параметр b отражает уменьшение объема, в котором могут свободно перемещаться молекулы. Кроме собственного объема молекул он учитывает уменьшение доступного для перемещения объема вследствие сил отталкивания, которые действуют при тесном сближении молекул. Величина b приблизительно в 4 раза превышает собственный объем молекулы.
Параметры а и b для разных газов различны, поэтому уравнение Вандер-Ваальса не является универсальным.