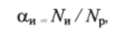В растворе слабых электролитов наряду с ионами существуют неионизированные молекулы.
Для количественной характеристики полноты диссоциации введено понятие степени диссоциации (ионизации).
Степенью диссоциации (ионизации) электролита сц, называется отношение числа молекул, распавшихся на ионы, к общему числу его молекул, введенных в раствор.
Иначе говоря, аи — доля молекул электролита, распавшихся на ионы. Степень диссоциации а" выражается в процентах или долях единицы:
где - число молекул электролита, распавшихся на ионы, Np — число молекул электролита, введенных в раствор (растворенных).
Так, для с (СН3СООН) = 0,1 моль/л степень диссоциации аи = 0,013 (или 1,3%).
По степени диссоциации электролиты условно подразделяют на сильные (а" > 30%) и слабые (аи < 3%). В диапазоне значений а" от 3 до 30% электролиты считаются средней силы.
К сильным электролитам относят почти все соли. Из наиболее важных кислот и оснований к ним принадлежат H2SO4, НС1, НВг, HI, HNO3, NaOH, КОН, Ва (ОН)2.
К слабым электролитам причисляют большинство органических кислот, а также некоторые неорганические соединения: H2S, HCN, Н2СОз, НСЮ, Н20, Н3ВО3, Н&С12, Fe (SCN)3 и др.
Для сильных электролитов степень диссоциации является кажущейся, так как они диссоциируют на ионы практически полностью. Отклонение изотонического коэффициента / от целочисленных значений объясняется для них не присутствием в растворе недиссоциированных молекул, а другими причинами.
Диссоциация сопровождается выделением или поглощением теплоты. Следовательно, степень диссоциации должна зависеть от температуры. Влияние температуры можно оценить по принципу Ле Шателье. Если электролитическая диссоциация протекает с поглощением теплоты (АН> 0), то при повышении температуры а" увеличивается, если с выделением теплоты (АII < 0), то а" уменьшается.
На степень электролитической диссоциации влияет концентрация раствора. Из табл. 8.4 видно, что при разбавлении раствора степень диссоциации значительно возрастает. В связи с этим указанная классификация силы электролитов по степени диссоциации аи справедлива только для растворов с концентрацией с (Х) порядка 0,1 моль/л.
Таблица 8.4
Степень (aj и константа (КЛ) диссоциации уксусной кислоты СНэСООН при различных концентрациях с (Х) в воде (291 К).
с (Х), моль/л. | а. | АГ" моль/л. |
0,28. | 0,539. | 1,7710 5 |
0.111. | 0,328. | 1,78−10'5 |
0,218. | 0,248. | 1,78−10-5 |
0,1 030. | 0,124. | 1,80−10″ 5 |
0,50 000. | 0.019. | 1,84−10″ 5 |
0,100 000. | 0,0135. | 1,85−10'5 |