Основные типы химических реакций
Химическая реакция – это процесс, в результате которого меняется строение вещества и/или его состав. Это первый признак, по которому все реакции делят на две группы:
- без изменения состава;
- с изменением состава.
В первую группу относят процессы изомеризации веществ, а также взаимные превращения аллотропных модификаций (О2 ↔ О3).
Вторая группа более многообразна. Ниже приведены признаки классификации и основные виды реакций в химии, протекающих с изменением состава вещества.
I. По числу и составу реагентов и продуктов выделяют реакции:
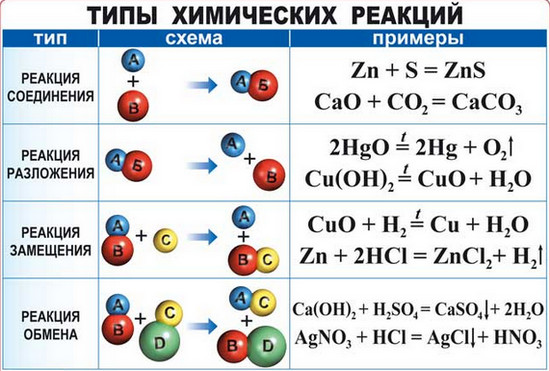
- Соединения (из нескольких веществ образуется одно: А+В+…=С).
SO3 + H2O = H2SO4 - Разложения (сложное вещество разлагается на несколько других, простых или сложных: А = В + С +…).
MgCO3↔MgO + CO2 - Замещения (реакция простого вещества со сложным, где атомы простого вещества занимают место атомов другого элемента в соединении: AB + C = B + CD).
2Na+2HOH = 2NaOH + H2 - Обмена (взаимодействие двух сложных веществ, в результате которого происходит обмен составными частями: AB + CD = AD + CB).
HCl +AgNO3 = HNO3 + AgCl
II. Тепловой эффект реакции (Q)
- Экзотермические – процессы, протекающие с выделением тепла.
C +O2 = CO2 +Q - Эндотермические – сопровождаются поглощение тепла.
N2 + O2↔ 2NO
III. В зависимости от наличия или отсутствия катализатора выделяют следующие основные типы химических реакций:
- Каталитические
2Al + 3I2→ кат. 2AlI3 - Некаталитические
P2O5 +3H2O = 2H3PO4
IV. Агрегатное состояние реагирующих веществ (фазовый состав)
- Гомогенные (границы раздела фаз нет, протекают в каждой точке объёма, все вещества в одном агрегатном состоянии).
H2(г) + Cl2(г) = 2HCl(г) - Гетерогенные (протекают на поверхности раздела фаз, вещества разных агрегатных состояниях).
Zn(тв) + H2O(ж) = ZnO (тв) + H2(г) – протекает на поверхности цинка
V. Изменение степени окисления – важный признак, по которому выделяют два основных типа химических реакций:
- ОВР или окислительно-восстановительные реакции
Mg0 + H2+1O−2 = Mg+2O−2 + H20 - БИСО (процессы, не сопровождающиеся изменением степеней окисления)
Mg+2(O−2H+12 = Mg+2O−2 + H+12O−2
VI. Направление
- Обратимые (одновременно протекают в двух направлениях)
H2 + C2H4↔C2H6 - Необратимые (идут только в одном из направлений)
2Mg +O2 = 2MgO
Как видите, видов реакций в химии существует больше десятка. Весь вопрос в том, с какой точки зрения рассматривать процесс.