Как определять валентность химических элементов?
Как определять валентность химических элементов? С этим вопросом сталкивается каждый, кто только начинает знакомиться с химией. Сначала выясним, что же это такое. Валентность можно рассматривать как свойство атомов одного элемента удерживать определенное количество атомов другого элемента.
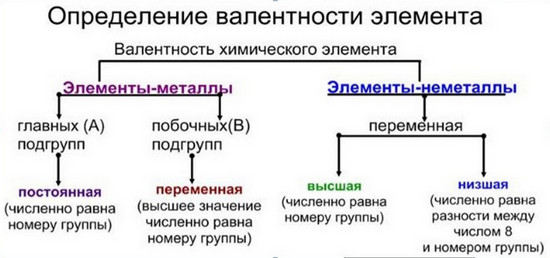
Элементы с постоянной и переменной валентностью
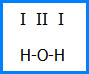
Например, из формулы Н-О-Н видно, что каждый атом Н соединен только с одним атомом (в данном случае с кислородом). Отсюда следует, что его валентность равна 1. Атом О в молекуле воды связан с двумя одновалентными атомами Н, значит он двухвалентен. Значения валентностей записывают римскими цифрами над символами элементов:
Валентности водорода и кислорода постоянны. Впрочем, для кислорода существуют и исключения. Например, в ионе гидроксония Н3О+ кислород трехвалентен. Существуют и другие элементы с постоянной валентностью.
- Li, Na, K, F – одновалентны;
- Be, Mg, Ca, Sr, Ba, Cd, Zn – обладают валентностью, равной II;
- Al, B – трехвалентны.
Теперь определим валентность серы в соединениях H2S, SO2 и SO3.
В первом случае один атом серы связан с двумя одновалентными атомами Н, значит его валентность равна двум. Во втором примере на один атом серы приходится два атома кислорода, который, как известно, двухвалентен. Получаем валентность серы, равную IV. В третьем случае один атом S присоединяет три атома О, значит, валентность серы равна VI (валентность атомов одного элемента помноженная на их количество).
Как видим, сера может быть двух-, четырёх- и шестивалентной:
Про такие элементы говорят, что они обладают переменной валентностью.
Правила определения валентностей
- Максимальная валентность для атомов данного элемента совпадает с номером группы, в которой он находится в Периодической системе. Например, для Са это 2, для серы – 6, для хлора – 7. Исключений из этого правила тоже немало:
-элемент 6 группы, О, имеет валентность II (в H3O+ – III);
-одновалентен F (вместо 7);
-двух- и трехвалентно обычно железо, элемент VIII группы;
-N может удержать возле себя только 4 атома, а не 5, как следует из номера группы;
-одно- и двухвалентна медь, расположенная в I группе. - Минимальное значение валентности для элементов, у которых она переменная, определяется по формуле: № группы в ПС – 8. Так, низшая валентность серы 8 – 6 = 2, фтора и других галогенов – (8 – 7) = 1, азота и фосфора – (8 – 5)= 3 и так далее.
- В соединении сумма единиц валентности атомов одного элемента должна соответствовать суммарной валентности другого.
- В молекуле воды Н-О-Н валентность Н равна I, таких атомов 2, значит, всего единиц валентности у водорода 2 (1×2=2). Такое же значение имеет и валентность кислорода.
- В соединении, состоящем из атомов двух видов, элемент, расположенный на втором месте, обладает низшей валентностью.
- Валентность кислотного остатка совпадает с количеством атомов Н в формуле кислоты, валентность группы OH равна I.
- В соединении, образованном атомами трех элементов, тот атом, который находится в середине формулы, называют центральным. Непосредственно с ним связаны атомы О, а с кислородом образуют связи остальные атомы.
Используем эти правила для выполнения заданий:
- Определим валентности Cr и О в веществе, формула которого Cr2O3.
Точно известно, что кислород двухвалентен. Всего он образует 2×3=6 единиц валентности.
По правилу 3 два атома хрома образуют столько же валентных связей, что и кислород, то есть 6.
Разделим полученное значение на количество атомов хрома: 6÷2=3.

- Рассмотрим, как определить валентность элементов в соединении CS2.
Здесь и S, и C обладают переменной валентностью. По правилу 4 валентность серы будет 8 – 6 = 2 (элемент, расположенный на втором месте, имеет низшую валентность). Теперь умножим полученное значение на индекс 2 (количество ат. S), получим: 2×2=4. Разделим результат на количество атомов С: 4÷1=4. Это и будет его валентность.

- Определим валентность серы в сульфате натрия – Na2SO4.
Здесь вспоминаем правило 6. Сера – центральный атом, непосредственно с ней соединяется кислород, а уже с ним – атомы Na. Валентность О равна II, всего таких атомов 4, вместе они образуют 8 единиц валентности. Na одновалентен. Из 8 единиц валентности кислород с натрием образует 2, остальные валентные единицы приходятся на серу: 8 – 2= 6.

Теперь вы знаете, как определять валентность химических элементов в разных случаях.