Примеры окислительно-восстановительных реакций
Химические процессы происходят не только в пробирках. Их непрерывное течение и поддерживает жизнь на Земле. Рассмотрим примеры окислительно-восстановительных реакций, с которыми мы сталкиваемся в повседневной жизни. Что случится с обычным гвоздем, если он полежит какое-то время в воде или просто во влажном воздухе? Конечно, он заржавеет. Это одна из многочисленных окружающих нас окислительно-восстановительных реакций.
Осталось расставить коэффициенты. Сделаем это методом электронного баланса.
1. Определим степени окисления (ст.о.) всех атомов.
Железо и кислород в левой части уравнения – простые вещества, значит их ст.о. равны нулю. В составе продукта реакции, гидроксида железа (III), железо имеет ст.о. +3, так как О и Н в составе гидроксогруппы ОН имеют ст.о соответственно -2 и +1. В сумме получается 1 – 2 = -1. Таких групп в составе Fe(ОН)3 три штуки, значит суммарно отрицательных зарядов 3 (-1×3=-3). Количество положительных зарядов должно соответствовать количеству отрицательных, то есть степень окисления железа +3.
2. Степени окисления изменяют Fe (из 0 переходит в +3) и О (из 0 переходит в -2). Водород в приведенном примере степень окисления не изменяет. Запишем полуреакции:
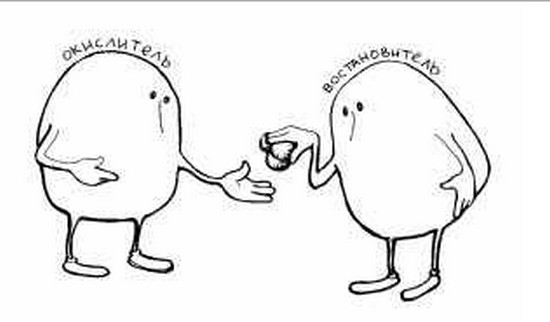
Частицы, которые в окислительно-восстановительных процессах отдают электроны, называют восстановителями, а процесс потери электронов – окислением. Присоединение электронов называют восстановлением, а частицу, которая их принимает – окислителем.
В данном примере отдает электроны Fe. Это и есть восстановитель. Окислитель в этой реакции – молекула кислорода, она принимает 4 электрона.
3. Количество отданных и принятых электронов должно быть одинаково. Находим общее кратное для 3 и 4. Оно равно 12. Именно столько электронов всего должен принять кислород и такое же их количество необходимо отдать атомам железа. Для этого перед железом в правой и левой частях уравнения ставим коэффициент 4, перед молекулой кислорода добавляем 3. Водород уравниваем методом подбора. В правой части 12 атомов Н, в левой только 2, значит перед формулой воды необходимо добавить коэффициент 6. Получаем в итоге:
Приведем другие примеры окислительно-восстановительных реакций.
Горение спички – знакомый с детства процесс. Он складывается из нескольких окислительно-восстановительных реакций. Сначала от трения загорается фосфор на боковой намазке коробка:
Затем пламя поджигает бертолетову соль и серу:
Примеры окислительно-восстановительных реакций, с которыми мы встречаемся ежедневно, можно увидеть повсюду. Фотосинтез, без которого невозможна жизнь на Земле, горение бенгальской свечи, без которой немыслим самый сказочный праздник, шипение перекиси водорода на кровоточащей ране – все это процессы, протекающие с изменением степеней окисления химических элементов.