Микробиология анаэробной очистки сточных вод

Грамположительные кокки играют значительную роль в сбраживании стоков свиноферм. Недавние исследования 130 культур, выделенных из таких сбраживателей, позволили идентифицировать представителей Peptostreptococcus, Eubacterium, Bacteroides, Lactobacillus, Peptococcus, Clostridium, Streptococcus. Гидролитические бактерии используют ряд экзоферментов, таких как протеазы, липазы, амилазы, целлюлазы… Читать ещё >
Микробиология анаэробной очистки сточных вод (реферат, курсовая, диплом, контрольная)
Недавние успехи в изучении микробиологического и биохимического механизмов анаэробного сбраживания дают возможность оптимизации управления процессом, в частности предупреждения нестабильности в работе сбраживателя. Несмотря на развитие современной технологии выделения и культивирования облигатных анаэробов и наличие некоторых данных о составе микробных популяций в сбраживателях для городских и животноводческих стоков, о таксономии этих микроорганизмов известно пока мало. Хотя биохимические механизмы ферментации в смешанной культуре еше не вполне изучены, все лучшее понимание этих сложных взаимосвязей порождает доверие к широкомасштабному промышленному применению анаэробного сбраживания загрязнений. Процессы, протекающие в основном в бактериальной биомассе, включают конверсию сложных органических субстратов, таких как полисахариды, липиды и белки, в СН4 и С02. Благодаря тому что бактериальное сообщество может менять используемые пути ферментации, оно функционирует как саморегулирующаяся система, поддерживающая значение pH, окислительно-восстановительного потенциала и термодинамическое равновесие оптимальным для роста образом и, следовательно, обеспечивающая стабильность сбраживателя.
По своим пищевым потребностям эти бактерии могут быть разделены на три обширные группы. П ервая включает гидролитические бактерии-бродилыцики, обычно называемые ацидогенными, так как они обеспечивают начальный гидролиз субстрата и сбраживание углеводов до низкомолекулярных органических кислот и других малых молекул. Вторая группа представляет собой гетероацетогенные бактерии, которые продуцируют СН3СООН и Н2. Третья — это метаногенные микроорганизмы (метаногены), которые продуцируют СН4. Эта последняя группа может быть в дальнейшем подразделена на потребителей водорода (литотрофов), ук;

Рис. 25. Пути биодеградации субстрата при анаэробном сбраживании.
сусной кислоты (ацетотрофов) и одноуглеродных (С,) соединений (рис. 25).
Синергические эффекты, происходящие при сосуществовании этих групп, например различные скорости потребления субстратов и роста, могут быть объяснены совместным культивированием и возникают в результате взаимодействий, таких как видовой перенос водорода. Субстраты, содержащие серу и азот, могут вызывать рост еще двух дополнительных групп: сульфатредуцирующих бактерий и денитрификаторов.
Кроме характера субстрата, на состав популяции в процессе смешанной ферментации также влияют другие условия культивирования. Один из таких параметров — температура. Сбраживатели могут работать в криофильных (не выше 20 °С), мезофильных (20—45 °С) или термофильных (50—65 °С) условиях. Термофильные сбраживатели имеют высокие скорости реакции, но часто получаемая при этом выгода недостаточно велика, чтобы возместить стоимость дополнительной тепловой энергии, необходимой для поддержания более высоких температур. К тому же в этих условиях существует мало разновидностей, которые могут влиять на способность системы адаптироваться к различным субстратам или ингибирующим соединениям.
Поэтому большинство установок в настоящее время работает в температурном интервале 34—38 °С, что экономически выгодно и к тому же допускает существование большего числа видов микроорганизмов. Таким образом, дальнейшая информация будет относиться в основном к мезофильному сбраживанию.
Ниже приведены некоторые продукты анаэробного сбраживания — соединения, образующиеся в количестве, превышающем 0,2 моль на моль субстрата в неперегруженном анаэробном сбраживателе:
- • органические кислоты — уксусная, пропионовая, масляная, капроновая, муравьиная, молочная, янтарная;
- • спирты и кетоны — метанол, этанол, изопропиловый спирт, бутанол, глицерин, ацетон;
- • газы — водород, метан, С02;
- • ферменты — целлюлаза, алкогольдегидрогеназа;
- • витамины — рибофлавин, витамин В12.
Из других продуктов, образующихся в малых количествах, можно назвать малоновую кислоту, некоторые жирные кислоты с более длинной цепью и изомерные жирные кислоты, концентрация которых зависит от характеристик источника питания и культуральных условий.
Микроорганизмы анаэробного ила могут быть как облигатными, так и факультативными анаэробами. При сбраживании в мезофильных условиях размеры популяции гидролитических бактерий колеблются от 105—106 до 108—109 клеток на 1 мл ила. В нем можно обнаружить представителей различных родов, включая образующие и необразующие спор грамположительные палочки, такие как протеолитические Eubacterium, целлюлозолитические Clostridium, облигатные анаэробы, такие как Acetobacterium, Bacteroides и Bifidobacterium и факультативные анаэробы Streptococcus и сем. Enterobacteriaceae.
Грамположительные кокки играют значительную роль в сбраживании стоков свиноферм. Недавние исследования 130 культур, выделенных из таких сбраживателей, позволили идентифицировать представителей Peptostreptococcus, Eubacterium, Bacteroides, Lactobacillus, Peptococcus, Clostridium, Streptococcus. Гидролитические бактерии используют ряд экзоферментов, таких как протеазы, липазы, амилазы, целлюлазы и пектиназы. Эти ферменты часто видоспецифичны и могут отличаться от таковых у аэробных бактерий. Следовательно, процесс сбраживания представляет собой растворение природных субстратов, таких как белки, липиды, гомои гетерополисахариды (целлюлоза, пектин, крахмал и гем и целлюлоза). Анаэробная биодеградация лигнина не представляется возможной из-за необходимых для этого окислительных условий, хотя недавно сообщалось о биодеградации кониферилового спирта — основного компонента лигнина. Присутствие в качестве интермедиата фенилпропионовой кислоты также подтверждает версию о сбраживании лигнина по побочному метаболическому пути. Кроме природных субстратов, анаэробные популяции разрушают фенолы и серосодержащие соединения, находящиеся в стоках предприятий, осуществляющих такие процессы, как сульфатная варка, газификация угля и нефтехимических производств. Продукты брожения Moiyr меняться в зависимости от вида и штамма бактерий, состава и количества питательных веществ и других параметров культивирования: pH, температуры и окислительно-восстановительного потенциала (Eh). Гомоацидогенные виды, например Acetobacterium woodi, образуют, как правило, видоспецифичные продукты, но описано также много видов гетероацидогенных бактерий, например Lactobacillus brevis.
Даже у гомоацидогенных видов бактерий могут происходить изменения в составе вырабатываемых продуктов. Например, Clostridium formicoaceticum образует только уксусную кислоту во время логарифмической фазы роста, но начинает синтезировать, кроме того, муравьиную кислоту в стационарной фазе при низких значениях pH. Другие виды в этих условиях синтезируют масляную кислоту.
Важным фактором при гетероацидогенном процессе является концентрация водородных ионов. На ход процесса влияет как pH, так и редокспотснциал (Eh). Из-за широкого спектра видов, входящих в группу гидролитических ацидогенных бактерий, и их изменчивости они относительно устойчивы к изменениям условий культивирования, часть их — ацидофильна. Отмечалось, что среднее время генерации составляет для них 2—3 ч, т. е. относительно невелико для анаэробных процессов. Однако на эту группу неблагоприятно влияют низкие значения pH и Eh. В случае резкого возрастания концентрации водорода микроорганизмы выбирают альтернативный метаболический путь для того, чтобы, используя более восстановленные соединения, удалять водород и, следовательно, управлять его концентрацией. Например, при нормальном образовании уксусной кислоты из глюкозы получается 4 моль газообразного водорода и 2 моль уксусной кислоты на 1 моль субстрата:
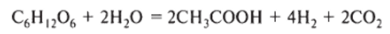
В случае резкого увеличения расхода или концентрации субстрата в сбраживателе микробная популяция немедленно на это реагирует, образуя избыточные количества Н2 и СН2СООН, снижая уровень Eh и pH. Если бы этот процесс продолжался беспрепятственно, то сбраживатель бы «прокис» и перестал работать. Однако ацидогенные бактерии используют управляющие обратные связи и выбирают альтернативные метаболические пути, такие как образование пропионовой и масляной кислот, что помогает восстанавливать стабильность сбраживателя: 
Эта роль водорода в управлении синтезом и потреблением промежуточных продуктов объясняет образование некоторых длинноцепочечных (с длиной цепи более 4 атомов водорода) жирных кислот, которые служат для накопления или расходования водорода. Эти процессы будут рассмотрены ниже, когда речь пойдет о II и III трофических группах.
Традиционно считалось, что процесс анаэробного сбраживания включает деятельность двух основных трофических групп — ацидогенных и метаногенных бактерий. Однако позднее стало ясно значение группы гетероацетогенных бактерий (группа II), осуществляющих симбиотическую ацетогенную дегидрогенизацию жирных кислот (с более длинной, чем у уксусной кислоты, цепью) — лимитирующую стадию при образовании метана. Некоторые исследователи выделяют гомоанетогснные бактерии, такие как Acetobacterium woodi, в отдельную четвертую трофическую группу, но в этой книге они включены в группу ацидогенных бактерий (группа I).
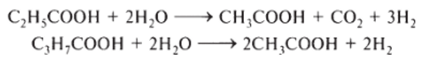
Описаны 2 новых вида гетероацетогенных неотрицательных бактерий: Syntrophobacrer wolinii и Syntrophomonas wolfei. В литературе сообщалось о популяции микроорганизмов этой группы, достигающей численности 4,2* I06 клеток на I мл сырого ила, и сейчас осуществляется дальнейшее изучение видов. Именно эти бактерии разлагают жирные кислоты (пропионовую и масляную), некоторые спирты и даже ароматические соединения (бензойную кислоту) в ряде случаев совместно с метаногенами.
Конверсия пропионовой и масляной кислот протекает следующим образом:
Низкое парциальное давление водорода, необходимое для биоконверсии жирных кислот гстероацетогенными бактериями, объясняет, почему они успешно растут только при совместном культивировании с утилизирующими Н2 метаногенными организмами и почему симбиоз и межвидовой перенос Н2 усиливают рост представителей обеих трофических групп.
Потребление жирных кислот с длинной цепью в присутствии избытка Н2 бывает вызвано как гидравлической перегрузкой сбраживателя, так и его перегрузкой по органическому субстрату.
Группой, предварительно перерабатывающей эти кислоты в пригодный для метаногенных организмов субстрат, являются гетероацетогенные бактерии, образующие СН3СООН и Н2, которые могут потребляться микроорганизмами III группы. Однако термодинамические расчеты показывают, что возрастание количества Н2 прекращает или даже обращает эти реакции. Следовательно, сбраживатель будет накапливать пропионовую, масляную и высшие жирные кислоты до концентрации нескольких тысяч миллиграммов на литр. Предупреждая остановки процесса от скачкообразных нагрузок или минимизируя их и поддерживая пригодные для культивирования условия, можно добиться того, что процесс постепенно возобновится так, что метаногенные организмы будут использовать Н2, а гетероацетогенные бактерии снова начнут потреблять высшие жирные кислоты. Следовательно, можно предполагать наличие корреляции между присутствием этих кислот и парциальным давлением Н2 в газовой смеси сбраживателя. С этой точки зрения ранним индикатором перегрузки, вызывающей неизбежную остановку работы сбраживателя, будет концентрация Н2 в биогазе.
Термодинамические ограничения, обсуждавшиеся выше, обусловливают тесный симбиоз между гстсроацстогснными и метаногенными бактериями. Воздействие массоперсноса может менять локальную концентрацию Н2 и влиять на кинетику процесса. Природа описанного синергизма еще полностью не объяснена, поскольку эти бактерии недостаточно таксономически и физиологически охарактеризованы. Различные типы биоэнергетики и уровень продуктивности могут быть видоспецифичны.
Третья (III) трофическая группа определяется на основе специфических субстратов, используемых для образования метана. К подгруппе 111 -А относятся хемолитотрофные организмы, они превращают Н2 и С02 в метан, используя газообразный Н2 как донор электронов:

В результате этой реакции происходит превращение одной молекулы АДФ в АТФ, следовательно, реакция термодинамически выгодна.
Микроорганизмы второй подгруппы III-B перерабатывают уксусную и муравьиную кислоты, метанол и метиламины в метан. Уравнение конверсии СН3СООН выглядит так:

Эта реакция дает только 0,25 моль АТФ и поэтому термодинамически относительно невыгодна.
Приведенные выше реакции нуждаются в специальных метаболических путях и специфичных ферментных кофакторах, которые были идентифицированы для каждой группы. Это, в частности, кофактор F430, тстрапиррольный комплекс никеля и кофермент420 «флуоресцирующее соединение сине-зеленого цвета, которое может быть использовано как средство диагностики метаногенов. Вся эта группа в целом проявляет уникальное видовое разнообразие, включая экологическую, физиологическую и морфологическую вариабельность. В нее входят микроорганизмы с клеточной стенкой разного типа, разнообразной морфологии (кокки, палочки, ланцетовидные), одноклеточные и нитчатые, подвижные и неподвижные, мезофильныс и термофильные и т. д.
Клеточные стенки этих организмов содержат псевдомуреин вместо муреина, характерного для эубактерий. Псевдомуреин содержит L-талозаминуроновую кислоту вместо мурамовой. Некоторые из клеточных оболочек построены на основе полипептидов или гликопротеидов. Отличия также наблюдаются в составе липидной фракции и последовательности нуклеотидов в рибосомальной РНК. Поэтому считается, что метаногенные бактерии принадлежат к архсбактериям, или археям (Archaebacteria, или Archaea), филогенетически древней группе, включающей также крайне галофильные и термоацидофильные микроорганизмы.
Численность популяции метаногенов в сбраживателе достигает 106—108 клеток на 1 мл сырого ила. Из него выделены представители Methanobacterium, Methanospirillum, Methanococcus, Methanosarci— na. Methanothrix. Из них такие виды, как Methanosarcina barkeri, Methanococcus mazei, Methanothrix soehngenii, демонстрируют способность расти на уксусной кислоте в чистой культуре с временем удвоения 1 — 10 сут или более. Все известные мстаногснные микроорганизмы, кроме Methanothrix soehngenii, способны к автотрофному потреблению Н2 и С02.
Установлено, что приблизительно 70—75% метана при анаэробной ферментации образуется из СН3СООН, следовательно, примерно 25—30% синтезируется авготрофно при потреблении С,-соединений. Это происходит вопреки термодинамической выгодности хемолитотрофного метаболизма и показывает, что концентрация водорода должна быть ограничена.
Метаногены — наиболее капризная с точки зрения культивирования группа среди микроорганизмов, участвующих в анаэробном сбраживании. Для роста они требуют широкого спектра питательных веществ, включая С, Р, N, S, Са, Mg, К, Na, органические субстраты. такие как аминокислоты, витамины и микроэлементы. Очевидно, что Н2 и С02 также являются необходимыми питательными веществами для роста хемолитоавтотрофов.
Большинство мезофильных метаногенов не будет расти при значениях pH ниже 5,5. Метаболизм Н2, СН3СООН и С,-соединений у них зависит от pH. Низкие значения pH в большей степени благоприятствуют восстановлению протона до водорода, нежели его восстановлению в СН4, и поэтому при таких условиях образование СН4 обычно приостанавливается. Кроме того, эмпирическим путем было показано наличие верхнего предела pH, равного 8.